湖南省衡阳市五校高三11月联考化学试卷
有关化学用语的表示正确的是
A.甲烷分子的比例模型是 |
B.二氧化碳的电子式: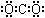 |
C.Cl—的结构示意图为: |
| D.HClO的结构式为H—O—Cl |
下列说法正确的是
| A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
| B.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
| C.Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 |
| D.日常生活中无水乙醇常用于杀菌消毒 |
“富勒烯”家族又增添了新成员,继C60、C70、N60之后,中美科学家首次发现了全硼富勒烯B40.下列说法正确的是
| A.B40、C70都属于新型化合物 |
| B.C60和14C互称同位素 |
| C.B40、C60、C70、N60都属于烯烃 |
| D.B40、C60、C70、N60都只含共价键 |
下列叙述中正确的是
| A.液溴易挥发,在存放液溴的试剂瓶中应加水封 |
| B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2 |
| C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- |
| D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+ |
除去下列括号内杂质的试剂或方法错误的是
| A.N2(O2):通过灼热的镁粉 |
| B.SiO2(Fe2O3):足量的盐酸,过滤 |
| C.CO2(SO2):酸性KMnO4溶液、浓硫酸,洗气 |
| D.C2H5OH(CH3COOH):加足量CaO,蒸馏 |
设NA为阿伏伽德罗常数的数值。下列说法正确的是
| A.0.1 mol·L-1的NaF溶液中所含F-的数目小于0.1NA |
| B.标准状况下,2.24L乙醇中含有的C—H键数目为0.5NA |
| C.0.1 molNa完全被氧化生成Na2O2,转移电子的数目为0.1NA |
| D.0.1 molO3和O2的混合气体中含氧原子数目为0.2NA |
质量分数为28%的KOH溶液中,平均多少个水分子溶有一个OH-
| A.6个 | B.10个 | C.8个 | D.28个 |
能正确表示下列反应的离子方程式是
| A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O |
| B.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+4H2O |
| C.磁性氧化铁溶于稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓ |
下列粒子在溶液中能大量共存的是
| A.K+、NO3-、I-、H2SO3 |
| B.Na+、Fe3+、NO3-、CO32- |
| C.Al3+、NO3-、SO32-、OH- |
| D.NH4+、Na+、SO42-、CH3COOH |
只用一种试剂就可将AgNO3、KSCN、稀H2SO4、NaOH四种无色溶液区分开,该试剂是
| A.BaCl2 溶液 | B.FeCl2溶液 |
| C.FeCl3溶液 | D.Fe(NO3)3溶液 |
已知:3Fe2++ NO3-+4H+= 3Fe3++ NO↑+2H2O,对于该反应的下列叙述中,不正确的是
| A.氧化剂和还原剂的物质的量之比为1∶3 |
| B.离子间的反应说明Fe(NO3)2溶液不宜加酸酸化 |
| C.每1 mol NO3-发生氧化反应,转移3 mol e- |
| D.若把该反应设计为原电池,则负极反应为Fe2+- e-=Fe3+ |
下列叙述正确的是
| A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成 |
| B.向Na2 CO3溶液中逐滴加入含等物质的量HCl的稀盐酸,生成的CO2与原Na2 CO3的物质的量之比为1:2 |
| C.等质量的Na HCO3和Na2 CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同 |
| D.向Na2 CO3饱和溶液中通入CO2,有Na HCO3结晶析出 |
以下物质间的转化通过一步反应不能实现的是
| A.HCl →Cl2→HClO→NaClO |
| B.Na→Na2O2→Na2CO3→NaHCO3 |
| C.Al→NaAlO2 →Al(OH)3→Al2O3 |
| D.Si→SiO2→H2SiO3→Na2SiO3 |
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中,属干这种情况的是
①过量锌与18 mol/L的硫酸反应;
②过量氢气与少量氮气在催化剂存在下充分反应;
③浓盐酸与过量的MnO2反应;
④过量铜与浓硫酸反应;
⑤过量稀硝酸与银反应;
⑥过量稀硫酸与大块状石灰石反应。
| A.②③④⑥ | B.②③⑤ | C.①④⑤ | D.①②③④⑤⑥ |
下列关于应用套管实验装置(部分装置未画出)进行的实验,叙述错误的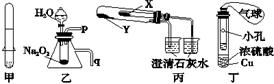
| A.利用甲装置可以制取少量H2 |
| B.利用乙装置可以验证Na2O2与水反应既生成氧气,又放出热量 |
| C.利用丙装置验证KHCO3和K2CO3的热稳定性,X中应放的物质是K2CO3 |
| D.利用丁装置制取SO2,并检验其还原性,小试管中的试剂可为酸性KMnO4溶液 |
下列各组物质的性质比较中,正确的是
| A.酸性:HClO4>H3PO4>H2SO4 |
| B.氢化物的稳定性:H2S>HF>H2O |
| C.碱性:Al(OH)3>Mg(OH)2>NaOH |
| D.氧化性:F2>C12>Br2>I2 |
在含有4 mol HCl和1 mol MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生的沉淀质量m与加入Ba(OH)2物质的量n之间的关系如图,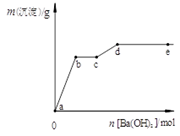
下列说法正确的是
| A.a→b时的沉淀的成分为BaSO4与Mg(OH)2 |
| B.b→c时发生的离子反应为:H+ + OH— → H2O |
| C.c→d时离子的物质的量:Ba2+可能大于Cl— |
| D.d→e时离子的物质的量:Ba2+一定大于OH— |
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好。(e处反应的化学方程式为:2KMnO4+16HCl===2MnCl2+5Cl2↑+8H2O)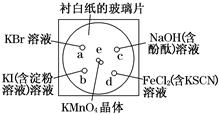
(1)e处反应中被氧化的HCl与参加反应的HCl的物质的量之比为 。
(2)b处的实验现象为___________________________________。
(3)c处反应的化学方程式为_____________________________________,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为 mol。
(4)通过该实验比较Cl2、FeCl3、KMnO4三种物质氧化性由强到弱的顺序是 。
如图所示的框图中,A~I都是由短周期元素组成的常见物质。其中A是气体,它的水溶液呈碱性;氧化物D和氧化物F都易与人体血液中的血红蛋白结合而使人中毒;单质E可作半导体材料。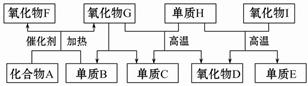
(1)化合物A的化学式是_______________________。
(2)组成单质E的元素在元素周期表中的位置是____________________________;
H+I反应的化学方程式为______________________________________。
(3)标准状况下,将2.24 L氧化物F和1.68 L单质B同时通入1 L氧化物G中(反应前后溶液体积的变化忽略不计),所得溶液的pH=___________。此时再向溶液中通入2.24 L化合物A,完全反应后所得溶液的pH<7,用离子方程式表示其原因:____________________________________。
(4)单质B和单质C在一定条件下可组成原电池(用KOH溶液作电解质),则该原电池负极的电极反应式为________________________________________________。
某化学兴趣小组用铜和浓硫酸制取SO2,并依次检验SO2具有酸性氧化物的性质和还原性、漂白性、氧化性,所用仪器如下图所示(图中连接胶管、夹持和加热装置省略): 
查阅资料可知,HSO3- 的酸性强弱与H2CO3相近。请回答下列问题:
(1)装置A中发生反应的化学方程式是:A
(2)上述装置的接口连接顺序依次是a→ → → → →g→h→d(填导管接口字母)。
(3证明SO2具有氧化性的现象是 ;证明SO2具有还原性的实验中,反应的离子方程式是 。
(4)C试管中NaOH溶液的作用是 ,CCl4的作用是 。
茶是我国人民喜爱的饮品。我市某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有Ca、Al、Fe三种元素。
【查阅部分资料】草酸铵[(NH4)2C2O4]属于弱电解质。草酸钙(CaC2O4)难溶于水。Ca2+、Al3+、Fe3+完全沉淀的pH为Ca(OH)2:pH≥13;Al(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。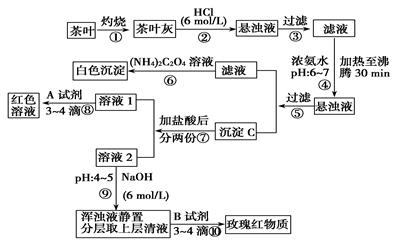
请根据上述过程及信息填空:
(1)步骤②加盐酸的作用是 。
(2)写出检验Ca2+的离子方程式 。
(3)写出沉淀C所含主要物质的化学式 。
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式 。
(5)步骤⑨的作用是 。
(6)称取400g茶叶样品灼烧得灰粉后,加入过量盐酸后过滤,将所得滤液加入过量的(NH4)2C2O4溶液,再过滤、洗涤、干燥、称量得到5.12g沉淀,原茶叶中钙元素的质量分数为 。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号