铜跟稀硝酸可发生反应:3Cu + 8HNO3(稀)=3Cu(NO3)2 + 2NO↑+ 4H2O。在该反应中,铜元素的化合价 (填“升高”或“降低”),被 (填“氧化”或“还 原”);硝酸体现_____________性,若反应中生成转移0.6mole,则生成___ L NO(标况)。
原”);硝酸体现_____________性,若反应中生成转移0.6mole,则生成___ L NO(标况)。
21在Fe + 2HCl ="=" FeCl2(氯化亚铁) + H2↑ 反应中。
② 此反应若转移了12mol的电子,则生成氢气 L(标准状况下).
已知: ① 2FeCl3 + 2KI ="=" 2FeCl2 + 2KCl + I2, ② 2FeCl2+Cl2 ="==" 2FeCl3
根据①②两式判断各物质的氧化性由强到弱的顺序 。
| A.FeCl3 > Cl2 > I2 | B.Cl2 > FeCl3 > I2 | C.I2> Cl2 > FeCl3 | D.Cl2> I2> FeCl3 |
以下有水参与的化学反应都属于氧化还原反应,但水既不做氧化剂又不做还原剂的有 。
①2Na2O2+2H2O=4NaOH+O2↑ ②Cl2+H2O="HCl+HClO "
③C+H2O=CO+H2 ④3NO2+H2O=2HNO3+NO
⑤2Na+2H2O=2NaOH+H2↑ ⑥2F2+2H2O=4HF+O2
(1)下列反应中都有水参加:
| A.Cl2+ H2O +Na2SO3="=" 2HCl + Na2SO4 |
| B.3NO2 + H2O ="=" 2HNO3 + NO↑ |
| C.NaH +H2O ="=" NaOH + H2↑ |
| D.2H2O 电解2H2↑+ O2↑ |
其中,水只是氧化剂的是 ,水既不是氧化剂又不是还原剂的是 ,(各1分)
(2)在3BrF3+5H2O=9HF+HBrO3+O2↑+Br2反应中,若有5.4gH2O被氧化,
则被还原的BrF3共 mol,其中被水还原的BrF3是 mol。(各2分)
某反应中反应物与生成物有: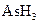 、
、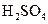 、
、 、
、 、
、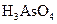 、Br2和。
、Br2和。
(1)配平上述化学反应方程式并标出电子转移的方向和数目: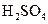 +
+ +
+ 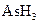 →
→ 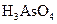 + Br2 +
+ Br2 +  + H2O
+ H2O
(2)反应中,被还原的元素是 ,还原剂是 。
(3)根据上述反应可推知 。
a.氧化性: b.氧化性:
b.氧化性:
c.还原性: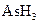 >Br2 d.还原性:
>Br2 d.还原性: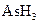 > Br2
> Br2
某一反应体系中有反应物和生成物共五种物质:O2.H2CrO4.Cr(OH)3.H2O.H2O2。 已知该反应中H2O2只发生如下过程:H2O2―→O2
已知该反应中H2O2只发生如下过程:H2O2―→O2
(1)该反应中的还原剂是________。
(2)该反应中,发生还原反应的过程是________→________。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目(用单线桥法)。
__________________________________________________________________
多原子分子氰(CN)2、硫氰(SCN)2和(OCN)2的性质与卤素单质相似,故称它们为拟卤素。它们可以生成酸和盐(见下表,表中X代表F、Cl、Br或I)。
| |
卤素 |
氰 |
硫氰 |
① |
| “单质” |
X2 |
(CN)2 |
(SCN)2 |
(OCN)2 |
| 酸 |
HX |
HCN |
② |
HOCN |
| 盐 |
KX |
KCN |
KSCN |
③ |
(1)在表中①②③空格处应分别填写_______、 、_______。
(2)完成下列反应的化学方程式或离子方程式。
①(CN)2和KOH溶液反应的化学方程式为: 。
②已知阴离子的还原性强弱为:Cl-<Br-<CN—<SCN-<I-。试写出在NaBr和KSCN的混合溶液中加入(CN)2反应的离子方程式:____________________________________。
2001年1月6日,我国525名两院院士投票评选出1999年中国十大科技进步奖,其中一项是:储氢碳纳米管研究获重大进展。电弧法合成的碳纳米管,常伴有大量杂质——纳米颗粒。这种碳纳米颗粒可用氧化汽化法提纯。 其反应式是3C+2 K2Cr2O7+ 8H2SO4 3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O
其反应式是3C+2 K2Cr2O7+ 8H2SO4 3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O
(1)单线法标出电子转移的数目和方向。
(2)此反应的氧化剂是 氧化产物是 。
(3)H2SO4在上述反应中表现出来的性质是 (填选项编号)
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
(4)上述反应中若产生0.1mol气体物质,则转移电子的物质的量是 mol.
某化学反应的反应物和产物如下:
KMnO4 + KI+ H2SO4→ MnSO4 + I2 + KIO3 + K2SO4 + H2O
(1)该反应的氧化剂是 。
(2)如果该反应方程式中I2和KIO3的化学计量数都是5
①KMnO4的化学计量数是 。
②在下面的化学式上标出电子转移的方向和数目
KMnO4 + KI + H2SO4 →
(3)如果没有对该方程式中的某些化学计量数作限定,可能的配平化学计量数有许多组。原因是 。
本题含两小题,共14分。
(1)某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
①将Au2O3之外的物质分别填如以下空格内,配平后标出电子转移的方向和数目。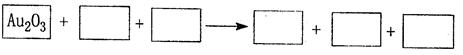
②反应中,被还原的元素是 ,还原剂是 。
③纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HC1,,则还原剂与氧化剂物质的量之比为
。
(2)按要求写出有水参与的氧化还原反应的化学方程式
①水是氧化剂:
②水是还原剂:
③水既不是氧化剂也不是还原剂: