高锰酸钾是一种典型的强氧化剂。完成下列填空:
I:在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① MnO4-+Cu2S+H+ Cu2++SO2↑+Mn2++H2O(未配平)
Cu2++SO2↑+Mn2++H2O(未配平)
② MnO4-+CuS +H+ Cu2++SO2↑+Mn2++H2O(未配平)
Cu2++SO2↑+Mn2++H2O(未配平)
(1)下列关于反应①的说法中错误的是 (填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8∶5
c.生成2.24 L(标况下)SO2,转移电子的物质的量0.8 mol d.还原性的强弱:Mn2+>Cu2S
II:在稀硫酸中,KMnO4与 (NH4)2Fe(SO4)2也能发生氧化还原反应。
(2)写出KMnO4与(NH4)2Fe(SO4)2反应的离子方程式: 。
(3)欲配制480mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为 g。需要的玻璃仪器有 .
III:实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3(s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。请回答:
(4)用软锰矿制备K2MnO4的化学方程式是: 。
(5)K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为 。并用单线桥表示电子的转移情况 。
金属铜能被氯化铁浓溶液腐蚀,其化学反应是:Cu+2FeCl3=CuCl2+2FeCl2。现将有铜的印刷线路板浸入120mL氯化铁浓溶液中,有9.6g铜被腐蚀掉。取出印刷线路板,向溶液中加入8.4g铁粉,经充分反应,溶液中还存在4.8g不溶解的物质。(设溶液体积不变,且不考虑金属离子水解)。请回答下列问题:
(1)向溶液中加入铁粉后,发生反应的离子反应方程式为 , 。
(2)充分反应后,溶液中存在4.8g不溶物的成分为 。
(3)充分反应后溶液中一定不存在的金属离子为 。
(4)比较Fe2+、Fe3+、Cu2+的氧化性大小: 。
(5)试计算最后溶液中Fe2+离子的物质的量浓度 mol/L
分析下列反应:3S+6 KOH = 2K2S+K2SO3+3H2O,据此作答:
(1)用双线桥标出该反应中电子的转移方向和数目:3S +6 KOH = 2K2S+K2SO3+3H2O
(2)该反应的氧化产物是 。
(3)该反应的氧化剂与还原剂的质量比是 。
(4)当消耗0.3 mol S时,则转移的电子数是 。
Cl2、Br2、I2都具有氧化性,其氧化性Cl2>Br2>I2,Cl2能把溴从溴化物中置换出来,其余类推。
(1)实验室用MnO2制备Cl2的反应中氧化剂是 ,氧化产物是 。将17.4g MnO2与足量的浓盐酸反应,则被氧化的HCl的物质的量为 。
(2)将溴水滴入KI溶液中的化学方程式为 。
(1)已知:2Fe3++2I-===2Fe2++I2, 2Fe2++Br2===2Fe3++2Br-。
①根据以上方程式比较Fe2+、Br-、I-还原性的强弱
②含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是________
(2)在硫酸铝、硫酸钾和明矾的1 L混合溶液中,如果SO42-浓度为0.4 mol/L,当加入等体积0.4 mol/L KOH溶液时,生成的沉淀恰好完全溶解,反应后混合溶液中K+的浓度为_______mol/L
(1)已知反应MnO2+4HCl (浓) MnCl2+Cl2↑+2H2O中,若二氧化锰与足量的浓盐酸反应制得3.55gCl2,通过计算回答:用双线桥标出反应中电子转移的方向和数目 ,参加反应的HCl的物质的量为 ,其中被氧化的HCl的质量 。
MnCl2+Cl2↑+2H2O中,若二氧化锰与足量的浓盐酸反应制得3.55gCl2,通过计算回答:用双线桥标出反应中电子转移的方向和数目 ,参加反应的HCl的物质的量为 ,其中被氧化的HCl的质量 。
(2)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、 H3AsO4、H2O和一种未知物质X。
①已知KBrO3在反应中得到电子,则该反应的还原剂是____________________。
②已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为_______,写出一个包含上述七种物质的氧化还原反应方程式(不需配平)_________ ________。
③根据上述反应可推知( )
| A.氧化性:KBrO3>H3AsO4 | B.氧化性:H3AsO4>KBrO3 |
| C.还原性:AsH3>X | D.还原性:X>AsH3 |
下面三个方法都可以用来制氯气:
①4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②KClO3+6HCl=3Cl2↑+KCl+3H2O
③KMnO4+HCl(浓)—KCl+MnCl2+Cl2↑+H2O(未配平),
根据以上三个反应,回答有关问题:
(1)反应的②的离子方程式为________________。
(2)反应②中,氧化产物与还原产物的质量比为____________。
(3)请将反应③配平:__KMnO4+__HCl(浓)=__KCl十__MnCl2+__Cl2↑+__H2O
(4)若要制得相同质量的氯气,①②③反应中电子转移的数目之比为_________。
(5)已知反应④:4HCl(g)+O2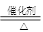 2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为________________。
2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为________________。
(1)下列几种物质:①H2O、②Fe(OH)3胶体、③Mg、④蔗糖、⑤盐酸溶液、⑥Ca(OH)2、属于电解质的是 ,属于分散系的是 ;(用数字序号填空)
(2)含氧原子数相同的SO2和SO3的质量之比是 ,物质的量之比是 。
(3)已知: 2Fe3++2I-===2Fe2++I2,2Fe2++Br2===2Fe3++2Br-,Cl2+2Br-===2Cl-+Br2。 向含有1 mol FeI2和1mol FeBr2的溶液中通入2 mol Cl2,充分反应后,此时被氧化的离子是________;(填写离子符号),如果向上述原溶液中通入3 mol Cl2,充分反应后,此时所得溶液中含有的离子 。(填写离子符号,忽略水的电离)
(1)通常状况下,已知X、Y两种气体,其质量分别为a、b时,体积之比为2:3。 两种气体X、Y的相对分子质量之比为________;相同条件下的X、Y两种气体,体积相同时,则X、Y的密度之比为__________;相同条件下,同质量的两种气体,X与Y的分子数之比为________。
(2)已知下列反应能发生:
2A3+ + 2B - = 2A2+ + B2;
C2 + 2B- = 2C- + B2;
2A2+ + C2 = 2A3++ 2C-
上述三个反应中氧化剂的氧化性强弱顺序为___________;还原剂的还原性强弱顺序为___________。
(3)一定条件下硝酸铵受热分解的化学方程式为: NH4NO3→HNO3+N2↑+H2O(未配平),写出配平后的化学方程式:________________________。在反应中被氧化与被还原的氮原子数之比为
(4)氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。古诗词是古人为我们留下的宝贵精神财富,下列诗句不涉及氧化还原反应的是( )
| A.野火烧不尽,春风吹又生 |
| B.春蚕到死丝方尽,蜡炬成灰泪始干 |
| C.粉身碎骨浑不怕,要留清白在人间 |
| D.爆竹声中一岁除,春风送暖入屠苏 |
水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用下图表达。
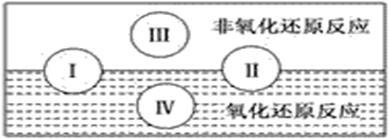
试写出有水参加的符合反应类型Ⅳ的一个化学方程式___________________________
(并非只有得氧、失氧的反应才是氧化还原反应,凡是有元素化合价升降的化学反应都是氧化还原反应。现在如下氧化还原反应,回答下列问题:
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)氧化剂是_________,氧化产物是________
(2)未变价元素是_______,将反应成离子方程式________
(3)用单线桥表示转移的电子数:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(4)氧化产物和还原产物的质量之比为___________________
(5)反应中生成3.6gH2O,转移电子数为_______个。
(6)已知铵盐受热易分解,硝酸铵在一定条件下发生的分解反应为:5NH4NO3=2HNO3+4N2↑+9H2O,当生成还原产物0.6mol时,转移的电子的物质的量是_________mol。
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓硝酸或浓硫酸反应生成二氧化硒以回收硒。完成下列填空:
(1) Se和浓硝酸反应的还原产物为一氧化氮和二氧化氮,且一氧化氮和二氧化氮的物质的量比为1:1,写出硒和浓硝酸的反应方程式 。
(2)已知:Se+2H2SO4(浓)→ 2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O → Se+2SO32-+4H+
SeO2、 H2SO4(浓)、 SO2的氧化性由强到弱的顺序是 。
(3)回收得到的二氧化硒的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3→Se+I2+KNO3+H2O ②I2+2Na2S2O3 → Na2S4O6+2NaI配平方程式①,标出电子转移的方向和数目。
(4)实验中,准确称量二氧化硒样品0.1500g,消耗了0.2000mol/L的Na2S2O3溶液25.00mL,所测定的样品中二氧化硒的质量分数为 。
(1)实验室制取Cl2的反应方程式之一为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O被氧化的盐酸占反应盐酸总量的 ,当标准状况下有11.2L氯气生成时,该反应的电子转移数为 。
(2)用双线桥法标出电子转移情况:3BrF3+5H2O=HBrO3+Br2+O2+9HF,当180g水都做还原剂时,被自身还原的BrF3是 mol。
(3)已知下列两个氧化还原反应:O2+4HI=2I2+2H2O 及Na2S+I2=2NaI+S,则三种单质的氧化性由强到弱的顺序为:
(6分)已知反应:① 2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O;② Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4;
③[ ]K2Cr2O7+[ ]FeSO4+[ ] H2SO4 =[ ]Fe2(SO4)3+[ ]Cr2(SO4)3+[ ]K2SO4+[ ]H2O
(1)上述三个反应中,属于氧化还原反应的是 (填序号);
(2)配平反应③的化学方程式 ;
(3)K2Cr2O7、I2、Fe3+三种微粒氧化性由强到弱的顺序: 。
(每空1分,共11分)从下列各组反应对比,判断那种微粒的氧化性最强。
(1)铁钉浸入硫酸铜溶液中后,表面会附有红色物质,铜丝浸入硝酸银溶液后,表面会附有银白色物质。则铜、铁、银中,_____ ___原子的还原性最强;Cu2+、Ag+、Fe2+中, 离子的氧化性最强。
(2)在氯气中Fe锈蚀成棕褐色物质FeCl3,而在盐酸中生成淡绿色溶液FeCl2。则氯气分子、氢离子、氯离子中, 具有氧化性, 氧化性最强。请书写出以上各反应的化学方程式________ 、 。
(3)已知在ⅣA族元素中,Pb2+和Sn4+的化合物较为稳定。
①据此可判断PbO2具有较强的________性,SnCl2具有较强的 性;写出PbO2溶于盐酸的离子方程式__________;写出SnCl2和FeCl3溶液混合的离子方程式__________ ;
②PbO2、Fe3+、Cl2、Sn4+氧化性由强到弱的顺序是__________ 。
过氧化氢H2O2(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
| A.Na2O2 +2HCl= 2NaCl+H2O2 |
| B.Ag2O+ H2O2=2Ag+O2+ H2O |
| C.2 H2O2="2" H2O+O2 |
| D.3 H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8 H2O |
(1)H2O2仅体现氧化性的反应是(填代号) 。
(2)H2O2既体现氧化性又体现还原性的反应是(填代号) 。
(3)B反应式中的氧化产物是 。
(4)上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是: 。