Ⅰ.
(1)某兴趣小组甲设计了以下装置和方法测定空气中SO2含量。你认为可行的操作是 (填序号)
| 序号 |
A |
B |
C |
| 装置 |
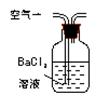 |
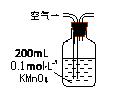 |
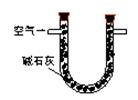 |
| 原理 |
通入V升空气,测定生成沉淀的质量 |
当KMnO4溶液刚好褪色时,测定通入空气的体积V |
通入V升空气,测定U型管增加的质量 |
(2)兴趣小组乙取336mL(标准状况)某由SO2和N2组成的混合气体Y,将其通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中SO2的体积分数为
。
Ⅱ.某化学兴趣小组丙为探究Fe3+是否能氧化SO2,设计了如下实验装置。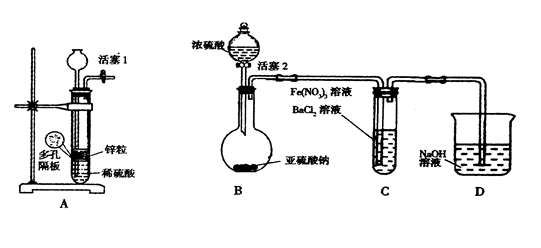
(1)如上图连接好装置。实验前应进行 操作
(2)观察到装置C中产生了白色沉淀,同学们提出了以下猜想(每个猜想只考虑一种物质的氧化性)。
猜想1: ;
猜想2:SO2被Fe3+氧化了;
猜想3:SO2被NO3—氧化了
(3)甲同学认为猜想1正确,并利用上述装置A进行了排除干扰的探究实验。
(4)乙同学认为猜想2正确,则装置C中反应的离子方程式是
(5)丙同学认为猜想3正确,他利用甲同学的实验装置,设计实验验证猜想。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:NaNO3溶液、KSCN溶液、FeCl3溶液、BaCl2溶液、
| 实验步骤 |
预期现象和结论 |
| |
|
Fe(NO3)3溶液
Ⅰ.铁盐、亚铁盐是实验室常用的药品。
请根据题意,完成下列填空:
(1)向酸化的FeCl3溶液中逐滴加入KI溶液,溶液变成棕褐色。该反应的离子方程式为________________。
(2)向酸化的FeSO4溶液中加几滴硫氰化钾溶液,没有什么明显变化,再滴加双氧水,溶液变血红色。继续滴加双氧水,血红色逐渐褪去,且有气泡产生。
写出上述变化中,有关反应的离子方程式:
①____________________________________;
②Fe3++3SCN-=Fe(SCN)3;
③11H2O2+2SCN-=2SO42—+2CO2↑+N2↑+10H2O+2H+
若生成1 mol N2,H2O2和SCN-的反应中转移电子的物质的量是________ mol。
(3)根据以上实验,推断Fe2+、I-和SCN-的还原性由强到弱的顺序为________。
Ⅱ.某课题组利用Fe粉和KNO3溶液反应,模拟地下水脱氮过程,探究脱氮原理。
(4)实验前:①先用0.1 mol·L-1 H2SO4洗涤Fe粉,其目的是__________,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液通入________(写化学式)。
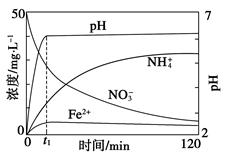
(5)如图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应生成的阳离子分别是________、________。t1时刻后,该反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是__________________。