安徽省濉溪县高一上学期期末考试化学试卷
环境污染问题越来越受到人们的关注,造成环境污染的主要原因是由于人类生产活动中过度排 放有关物质引起的。下列环境问题与所对应的物质不相关的是
| A.温室效应——CO2 | B.光化学污染——NO2 |
| C.酸雨——SO2 | D.臭氧层破坏——CO |
下列说法正确的是
| A.pH在 5.6~7.0之间的降水通常称为酸雨 |
| B.燃煤时加入适量石灰石,可减少废气中SO2的量 |
| C.新制氯水经光照一段时间pH增大 |
| D.测定某溶液pH应先用蒸馏水润湿pH试纸 |
在下列溶液中通入CO2至过量,原溶液一直保持澄清的是
| A.硅酸钠溶液 | B.氯化钡溶液 |
| C.石灰水 | D.漂白粉溶液 |
观察丁达尔现象的正确方法是
| A.观察者视线与入射胶体内一束光平行 |
| B.将一发光的白炽灯悬在盛有胶体的烧杯正上方 |
| C.观察者视线垂直于一束入射光,胶体置暗盒内 |
| D.胶体置明亮背景处,观察者视线与入射胶体内的红色激光垂直 |
下列各组物质,按强电解质、弱电解质、非电解质的顺序排列的是
| A.NaCl、BaSO4 、SO2 |
| B.Cu、CH3COOH、酒精 |
| C.氯化钠晶体、水、酒精 |
| D.KNO3、NH3·H2O、CaCO3 |
纯碱和小苏打都是白色晶体,在日常生活中都可以找到。若要在家中将它们区分开来,下面的方法中可行的是
| A.分别放在炒锅中加热,观察是否有残留物 |
| B.分别用干净铁丝蘸取样品在煤气炉的火焰上灼烧,观察火焰颜色 |
| C.将样品溶解,分别加入澄清石灰水,观察是否有白色沉淀 |
| D.在水杯中各盛相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度 |
下列离子在溶液中能大量共存的是
| A.Na+、CO32—、SO42—、H+ |
| B.K+、[Al(OH)4]—、H+、Cl— |
| C.Fe2+、K+、H+、NO3— |
| D.Al3+、H+、NO3—、SO42— |
下列离子方程式正确的是
| A.碳酸氢铵溶液与过量的氢氧化钠溶液反应H+ + OH—═H2O |
| B.氢氧化铝与足量盐酸反应Al(OH)3+3H+═Al3++3H2O |
| C.钠和冷水反Na+2H2O═Na++H2↑+OH— |
| D.铜片与稀硝酸反应Cu+NO3—+4H+═Cu2++NO↑+2H2O |
以下物质间的每步转化都可以通过一步反应能实现的是
| A.Al→Al2O3→Al(OH)3→Na [Al(OH)4] |
| B.Fe→FeO→Fe(OH)2→Fe(OH)3 |
| C.Si→SiO2→H2SiO3→Na2SiO3 |
| D.Na→Na2O2→Na2CO3→NaOH |
设NA为阿伏加德罗常数,下列叙述正确的是
| A.18g水中所含的电子数为8NA |
| B.11.2L氯气所含的分子数为0.5NA |
| C.2.4gMg与足量的盐酸反应失去的电子数为0.2NA |
| D.32g氧气中所含的氧原子数为N |
利用下列装置可以完成的实验组合是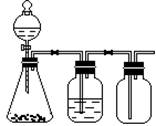
| 选项 |
制气装置 |
洗气瓶中试剂 |
瓶中气体 |
| A |
氯酸钾 MnO2 |
浓硫酸 |
O2 |
| B |
石灰石 稀盐酸 |
NaHCO3溶液 |
CO2 |
| C |
Zn 稀硫酸 |
浓硫酸 |
H2 |
| D |
MnO2 浓盐酸 |
浓硫酸 |
Cl2 |
在标准状况下,将V L气体A(摩尔质量为M g·mol-1)溶于100ml水中,所得溶液密度为d g·cm-3,则该溶液的物质的量浓度为
A.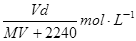 |
B. |
C. |
D. |
将下列性质的代号,填入各小题后面对应的括号中:
| A.脱水性; |
| B.强酸性; |
| C.难挥发性; |
| D.氧化性; |
E.吸水性
(1)将胆矾放入装有浓H2SO4的干燥器中,过一段时间胆矾变白色。 ( )
(2)在烧杯中放入蔗糖,滴入浓H2SO4变黑,并产生大量气体。 ( )
(3)用稀硫酸清洗金属表面的氧化物 ( )
过氧化氢H2O2(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
| A.Na2O2 +2HCl= 2NaCl+H2O2 |
| B.Ag2O+ H2O2=2Ag+O2+ H2O |
| C.2 H2O2="2" H2O+O2 |
| D.3 H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8 H2O |
(1)H2O2仅体现氧化性的反应是(填代号) 。
(2)H2O2既体现氧化性又体现还原性的反应是(填代号) 。
(3)B反应式中的氧化产物是 。
(4)上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是: 。
氮元素的单质和化合物在工、农业生产中用途广泛。而汽车尾气中含有NO等多种污染物。
(1)常用作食品袋中填充气的是 ;(填化学式)常用作制冷剂的化合物是 ,(填化学式)该物质在空气中与HCl相遇有白烟现象,产生该现象的化学反应方程式是 。
(2)铵盐在农业上大多用作化肥。实验室可用固体铵盐NH4Cl与固体Ca(OH)2加热反应来制备氨气,其化学方程式为 。
(3)汽车燃料中一般不含氮元素,但尾气却所含有NO,产生的原因用化学方程式表示 。
(4)NO对大气的影响之一是导致酸雨,用化学方程式表示NO形成酸雨的原因是 。
(9分)除杂(括号内为杂质):请把所加试剂和有关离子反应方程式填在空白处。
| |
试剂 |
离子反应方程式 |
| ①NaHCO3溶液(Na2CO3) |
|
|
| ②FeCl3溶液(FeCl2) |
|
|
| ③CO2(HCl) |
|
|
某氧化铝样品中含有氧化铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案。请回答下列问题: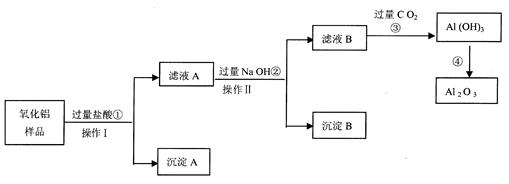
(1)沉淀A的成分是 (填化学式),沉淀B的成分是 (填化学式);
(2)写出第④步反应的化学方程式 ;
(3)在操作Ⅰ的名称是 ,其中玻璃棒的作用是 。
某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中。
请回答下列问题:
(1)写出铜与浓硫酸反应的化学方程式,标出电子转移的数目及方向: 。
(2)试管a、b分别检验生成气体的性质,写出观察到的现象及其作用。
试管a中的现象是 ,
作用是 。
试管b中的现象是 ,
作用是 。
(3)装置中浸碱棉团的作用是 。
(4)如图将铜丝改为可抽动的铜丝符合化学实验绿色化的原因是 。
取20mL硫酸和盐酸的混合液体,加入过量的氯化钡溶液,产生4.66g白色沉淀,然后继续向溶液中加入ag(足量)铁粉,产生的气体的体积为896mL(标准状况下)。
(1)写出上述过程中发生的离子方程式_______________________________________
________________________________________________________________________。
(2)计算原混合液体中,硫酸物质的量浓度是_________________mol/L,盐酸物质的量浓度是_____________________mol/L(写出计算过程)。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号