向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式___________________________________________________。
(2)下列三种情况下,离子方程式与(1)相同的是______(填序号)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO 恰好完全沉淀
恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用下图中的 ______曲线表示(填序号)。
(1)已知亚氯酸(HClO2)不稳定,可分解,分解反应的离子方程式为:HClO2→ClO2↑+H++Cl﹣+H2O(未配平).当有3.2mol电子发生转移时,发生分解的HClO2的物质的量是 mol.
(2)有Fe2+、NO3﹣、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,则该反应中氧化剂与还原剂的物质的量之比为 .
(10分)有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 |
K+ Na+ Cu2+ Al3+ |
| 阴离子 |
SO42- HCO3- NO3- OH- |
为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空
(1)写出B、D的化学式:B ,D 。
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 。
(3)在A溶液中加少入量澄清石灰水,其离子方程式为 。
(4)C常用作净水剂,用离子方程式表示其净水原理 。
(1)除去Mg粉中的Al粉的离子方程式为 ;
(2)除去FeCl2溶液中少量CuCl2杂质的试剂是 ,离子方程式为 ;
(3)加热条件下铁与水蒸气反应的化学反应方程式为 ;
(4)Fe(OH)2露置于空气中转化Fe(OH)3的化学反应方程式为 ;
亚铁盐不稳定,在空气中易被氧化,因此在存放FeSO4溶液时,常加入 ,其理由是 (用离子方程式表示)。
.查资料得:HNO2是一种弱酸且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。
试回答下列问题:
(1)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别 D. 用AgNO3和HNO3两种试剂来区别
(2)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的
Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填序号)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(3) Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
A.Cl2 B.Fe C.H2O2 D.HNO3
(4)某同学把酸性高锰酸钾溶液滴入NaNO2溶液中,观察到紫色褪去,同时生成NO3-和Mn2+,请写出反应的离子方程式:_____________________________________________。
(5)已知FeSO4在一定条件下可转变为高铁酸钾(K2FeO4),高铁酸钾是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是_______________________________________。
(本题3个空,每空2分,共6分)
在盛有100mL浓硝酸的试管中加入32g铜片发生反应。请回答:
(1)开始阶段,反应的离子方程式是 。
(2)若二者恰好完全反应,共产生气体11.2L(标准状况)。则浓硝酸的物质的量浓度为 。
(3)反应结束后的试管中,再加入金属铜和入少量20%的稀硫酸,这时溶液中又有气泡产生,请写出反应的离子方程式是 。
神舟十号飞船是中国“神舟”号系列飞船之一,它是中国第五艘搭载太空人的飞船。神舟十号飞船发射成功后,将与2011年发射升空的天宫一号目标飞行器进行交会对接,开展相关空间科学试验。火箭推进器是成功发射的重要因素,事实上,推进器的发展经历了一个漫长的过程。
(1)20世纪前,黑火药是世界上唯一的火箭推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式为:S+3C+2KNO3=K2S+N2↑+3CO2↑。
①K2S的电子式为 ,CO2的结构式为 。
②已知S和氯水反应会生成两种强酸,其离子方程式为 。
③取黑火药爆炸后的残留固体,加水溶解过滤,得到滤液。写出检验此溶液中是否含有K+的实验操作方法 。
(2)20世纪60年代,火箭使用的是液体推进剂,常用的氧化剂有四氧化二氮、液氧等,可燃物有麟(N2 H4)、液氢等。
①肼(N2 H4)溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式: 。
②一种与N2 H4电子数相等的绿色氧化剂,能将油画表面黑色的PbS氧化成白色的PbSO4,使油画变白、翻新,化学方程式为: 。
(3)以上的火箭推进剂一般含有氮元素,含氮化合物种类丰富。有一含氮化合物,具有很强的爆炸性,86g该化合物爆炸分解会生成标况下N267. 2L和另一种气体单质H2。写出其爆炸的化学方程式 。
(16分)实验室中以粗铜(含杂质)为原料,某种制备铜的氯化物的流程如下:
按要求回答下列问题:
(1)操作①的所用到的玻璃仪器有______________。
(2)上述流程中,所得固体1需要加稀盐酸溶解,其理由是 ;
溶液1可加试剂X用于调节pH以除去杂质, X可选用下列试剂中的(填序号)___________。
A.NaOH B.NH3·H2O C.CuO D.CuSO4
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出
制备CuCl的离子方程式: 。
(4)现用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)。
①按气流方向连接各仪器接口顺序是:a→ 、 → 、 → 、 → 。实验中大试管加热前要进行一步重要操作,其操作是 。
②反应时,盛粗铜粉的试管中的现象是 。
(5)在溶液2转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为绿色。小组同学欲探究其原因。已知:氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq) + 4Cl-(aq)  CuCl42-(aq) + 4 H2O (l)
CuCl42-(aq) + 4 H2O (l)
蓝色 绿色
该同学取氯化铜晶体配成蓝绿色溶液Y,进行如下实验,其中能证明溶液中有上述转化关系的是 (填序号)。
A.将Y稀释,发现溶液呈蓝色 B.在Y中加入CuCl2晶体,溶液变为绿色
C.在Y中加入NaCl固体,溶液变为绿色 D.取Y进行电解,溶液颜色最终消失
有失去标签的A、B、C、D四瓶溶液,它们的成分可能是Na2CO3、K2SO4、Ba(NO3)2、NaHSO4中的某一种,进行下列实验:
(1)A+C→溶液①+气体① (2)B+A→溶液②+沉淀①
(3)C+B→溶液③+沉淀② (4)溶液③+沉淀①→溶液④+气体①
根据上述实验结果,写出上述过程的离子方程式:
(1) 。
(2) 。
(3) 。
(4) 。
向200 mL 某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液。向上述所得溶液中,逐滴滴加2 mol·L-1的盐酸,所得气体的体积与所加盐酸的体积关系如图所示: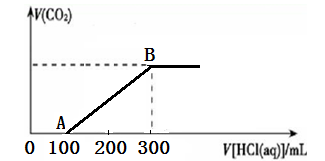
(1)OA段、AB段发生反应的离子方程式__________________、__________________。
(2)B点时,反应所得溶液中溶质的物质的量浓度是______________。
(1)现有下列物质 ①Fe、② HCl气体、③NaOH固体、④NH3气体、⑤ KCl溶液、⑥CH3COOH、⑦SO3、⑧乙醇、⑨BaSO4固体请用以上物质回答下列问题。(填序号)电解质: ;非电解质: ;上述状态能导电的是: 。
(2)按要求写出方程式。
①Mg(OH)2和盐酸: (写出离子方程式)
②足量澄清石灰水通入少量CO2: (写出离子方程式)
③Fe2(SO4)3: (写出电离方程式)
④H++OH—=H2O: (写出对应的化学方程式)
⑤CO32—+2H+=CO2↑+H2O: (写出对应的化学方程式)
石墨在材料领域有重要应用。某初级石墨中含(7.8%)、
(5.1%)、
(3.1%)和
(0.5%)等杂质。设计的提纯和综合应用工艺如下:

(注:的沸点是57.6ºC,金属氯化物的沸点均高于150ºC)
(1)向反应器中通入前,需通一段时间的
,主要目的是 。
(2)高温反应后,石墨中的氧化物杂质均转变为相应的氯化物。气体I中的氯化物主要为 。由气体II中某物质得到水玻璃的化学方程式为。
(3)步骤①为:搅拌、 。所得溶液IV中阴离子有。
(4)由溶液IV生成沉淀V的总反应的离子方程式为 。100初级石墨最多可获得
的质量为
。
(5)石墨可用于自然水体中铜件的电化学防腐,完成下图防腐示意图,并作相应标注。

是常见的六种元素。
(1)位于元素周期表第周期第族;
的基态原子核外有个未成对电子;
的基态原子核外电子排布式为。
(2)用">"或"<"填空:
| 第一电离能 |
离子半径 |
熔点 |
酸性 |
(3)与
反应生成
和一种黑色固体。在25 ℃、101
下,已知该反应每消耗1
,放热44.4
,该反应的热化学方程式是。
(4)是常用于水的净化,工业上可用
氧化
溶液制取
。写出该反应的离子方程式,并标出电子转移的方向和数目。