将饱和FeCl3溶液滴入沸水中,液体变为________色,得到的是_________,用此分散系进行下列实验:
⑴将其装入U型管中,用石墨电极接通直流电,通电一段时间后,发现阴极附近的颜色________,这说明________________,这种现象称为____________
⑵向其中加入饱和(NH4)2SO4溶液发生的现象是______________,原因是______________
⑶向其中滴入过量稀硫酸,现象是__________________________________________,其原因是______________________________________
某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH、Cl-、CO、SO,现分别取100 mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02 mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、干燥、灼烧后,得到1.02 g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65 g固体。
依据实验回答下列问题:
(1)由①可知一定存在的离子为 ,其浓度为 mol·L-1。
(2)写出②中产生沉淀的离子方程式 。
(3)由③可知一定存在的离子为 ,其浓度为 mol·L-1。
(4)综合上面三个实验,该混合物的水溶液中一定不存在的离子是 (填离子符号)。
(5)某同学通过分析认为该溶液中一定存在K+,他的理由是 。
某铝合金中含有铁、铝、镁、铜、硅。为了测定该合金中铝的含量,现设计了如下实验:
已知:Si+2NaOH+H2O=Na2 Si O3+2H2↑,H2Si O3是不溶于水的弱酸。
(1)固体A的成分是:____________,溶液M中的阴离子有:____________________
(2)步骤③中生成沉淀的离子方程式为:_____________________________________
(3)步骤④中,用到的仪器有三脚架、酒精灯以及
(4)在空气中将NaOH溶液滴入FeCl2溶液中,观察到的现象是 ,反应的化学方程式是 ,
(5)该样品中铝的质量分数是:_______________________________(用a、b表示)。
(6)下列因操作不当,会使测定结果偏大的是___________
| A.第①步中加入NaOH溶液不足 | B.第②步中加入盐酸不足时 |
| C.第④步中的沉淀未用蒸馏水洗涤 | D.第④步对沉淀灼烧不充分 |
(5分)向盛有1 mL 0.1 mol/L MgCl2溶液的试管中滴加1~2滴2 mol/L NaOH溶液,观察到有白色沉淀生成,该反应的离子方程式是________________。再滴加2滴0.1 mol/L FeCl3溶液,观察到白色沉淀转化为红褐色沉淀,该反应的离子方程式是___________________。由以上现象可以推知,相同条件下Mg(OH)2和Fe(OH)3中溶解度较大的是_________________。
(10分)Ⅰ.已知NaHS04是一种酸式盐,在工业上应用广泛,根据NaHS04的性质回答下列问题:
(1)写出NaHS04在水溶液中的电离方程式:
(2)若向NaHS04溶液中滴加Ba(OH)2至SO42-完全沉淀时的离子方程式为
(3)滴加Ba(0H)2溶液使溶液呈中性时的化学方程式为
Ⅱ.(4)若在标准状况下,将V L HCl气体溶于lL水中,所得溶液密度为dg/ml,则此溶液的物质的量浓度为
(5) 一定质量的铝铁合金溶于足量的NaOH溶液中,完全反应后产生3.36 L(标准状况下)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生5.6 L(标准状况下)的气体,则该合金中铝、铁的物质的量之比为
(1)向NaHSO4溶液中逐滴加入Ba(OH) 2溶液使SO42-恰好沉淀完全,请写出发生反应的离子方程式:______ 。
(2)在一定条件下,RO4n--和I-发生反应的离子方程式如下:RO4n- +8I- +8H+= R- +4I2 +4H2O中R元素的化合价为 .
(3)常温常压下,将CO与CH4的混合气体10L与25L氧气混合,点燃后充分反应,则剩余气体为24L(恢复为常温常压),则原来混合气体中CO与CH4的体积比为 。
(4)以物质的量之比为1:2相混合的Na2SO3和K2SO3的混合物共a g,与足量盐酸反应生成的SO2物质的量n(SO2)= mol(用含a的代数式表示)。
I.有以下物质:
①石墨;②铝;③酒精;④氨水;⑤二氧化碳;⑥碳酸氢钠固体;
⑦氢氧化钡溶液;⑧纯醋酸;⑨氯化氢气体。
(1)其中能导电的是 ;
属于非电解质的是 ;
属于强电解质的是 ;
属于弱电解质的是 。
(2)写出物质⑥溶于水的电离方程式: 。
(3)写出物质⑥和⑧在水中反应的离子方程式: 。
Ⅱ.今有K2SO4和Al2(SO4)3的混合溶液,已知其中K+浓度是0.2mol•L-1,SO42- 的浓度是0.7mol•L-1。
(4)则 Al3+ 物质的量浓度应等于 。
Ⅲ.根据反应8NH3+3Cl2 → 6NH4Cl+N2,回答下列问题:
(5)该反应中氧化剂是 ,氧化产物是 。
(6)该反应中被氧化的物质与被还原的物质物质的量之比为 。
(7)用单线桥法标出电子转移的方向与数目。
IV.有一包白色固体,可能含有K2CO3、NaNO3、KCl、BaSO4、CuSO4。按下列步骤实验:①取少量固体溶于水,得到无色溶液;②在所得的溶液中滴加硝酸银溶液,得到白色沉淀,再加稀硝酸,白色沉淀部分溶解,并有气体产生。根据上述实验现象判断:
(8)一定存在的物质是 ;
(9)一定不存在的物质是 ;
(10)可能存在的物质是 ;
现有下列十种物质:① O2 ② Fe ③ CaO ④CO2 ⑤ H2SO4 ⑥ Ba(OH)2 ⑦红褐色的氢氧化铁胶体 ⑧硫酸钠溶液 ⑨稀硝酸 ⑩Cu2(OH)2CO3.
(1)按物质的树状分类法填写表格的空白处:
| 分类标准 |
 |
氧化物 |
|
胶体 |
| 属于该类的物质 |
② |
|
⑧ ⑨ |
|
(2)上述物质属于非电解质的有 ;上述物质能与盐酸反应的电解质有 (填序号)。
(3)上述十种物质中有两种物质之间可发生离子反应:H++OH-= H2O,该离子反应对应的化学反应方程式为__ ________________________________________________________。
(4) 过量的②与⑨发生化学反应的化学方程式为:3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O,该反应的还原剂是 (填化学式),当生成0.05mol的NO气体时,转移的电子的物质的量为__________。
(本题3个空,每空2分,共6分)
在盛有100mL浓硝酸的试管中加入32g铜片发生反应。请回答:
(1)开始阶段,反应的离子方程式是 。
(2)若二者恰好完全反应,共产生气体11.2L(标准状况)。则浓硝酸的物质的量浓度为 。
(3)反应结束后的试管中,再加入金属铜和入少量20%的稀硫酸,这时溶液中又有气泡产生,请写出反应的离子方程式是 。
(每空1分,共11分)写出有关离子方程式
(1)Na2SO4溶液中滴加Ba(OH)2:
(2)H2S的电离方程:
(3)NH4Cl溶液显 性:
(4)纯碱溶液显 性:
(5)将FeCl3饱和溶液滴入沸水中:
(6)用明矾净水:
(7)在配制AlCl3溶液时,为了防止发生水解,可以加入少量的 ;在配制FeSO4溶液时,为了防止溶液变质,可以加入少量的 和 。
(16分)有一固体混合物,可能由K2CO3、Na2SO4、CuSO4、BaCl2、NaCl等其中的一种或几种混合而成。为检验它的成分,做了如下实验:
①将混合物加水溶解,搅拌后得无色澄清溶液。
②往此溶液中滴加足量硝酸钡溶液,有白色沉淀生成。
③过滤,将沉淀物置于足量稀硝酸中,发现沉淀完全不溶解。试判断:
(1)固体混合物中肯定有 ,肯定没有 ,可能有 。(均填化学式)
(2)对可能有的物质,如要检验其是否存在,将如何操作?______ ________________
(3)写出②③发生的有关反应的离子方程式:②
③____________________________________________ _______________ _____
(4)工业上常用电解氯化钠溶液的方法制Cl2,其化学方程式为: 2NaCl + 2H2O 通电 2NaOH + H2↑ + Cl2↑,用单线桥法表示该反应电子转移情况。
(本题16分)某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气体产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。回答下列问题:
(1) 若向该溶液中加入过量的稀硫酸和KSCN溶液,现象是:______________________
(2) 写出向该溶液中加入过量的稀硫酸发生反应的离子方程式为:
_________________________________________________________________________
(3) 经分析,该溶液所含的4种离子是:______________________________________
(4)判定另外3种离子不能存在的主要依据有三个:
①向该溶液中加入过量的稀硫酸,有气体产生,且溶液中阴离子种类不变、②所含离子的物质的量均为1mol,则③是__________________________________________。
(5) 若向该溶液中加入足量的NaOH溶液,将所得的沉淀过滤再灼烧,最后所得固体的质量为__________g。
向200 mL 某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液。向上述所得溶液中,逐滴滴加2 mol·L-1的盐酸,所得气体的体积与所加盐酸的体积关系如图所示: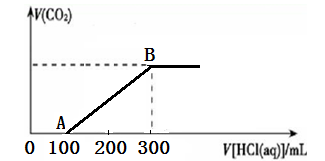
(1)OA段、AB段发生反应的离子方程式__________________、__________________。
(2)B点时,反应所得溶液中溶质的物质的量浓度是______________。
(1)现有下列物质 ①Fe、② HCl气体、③NaOH固体、④NH3气体、⑤ KCl溶液、⑥CH3COOH、⑦SO3、⑧乙醇、⑨BaSO4固体请用以上物质回答下列问题。(填序号)电解质: ;非电解质: ;上述状态能导电的是: 。
(2)按要求写出方程式。
①Mg(OH)2和盐酸: (写出离子方程式)
②足量澄清石灰水通入少量CO2: (写出离子方程式)
③Fe2(SO4)3: (写出电离方程式)
④H++OH—=H2O: (写出对应的化学方程式)
⑤CO32—+2H+=CO2↑+H2O: (写出对应的化学方程式)
湿法炼锌的冶炼过程可用下图简略表示:
请回答下列问题:
(1)已知:N2(g)+2H2(g)===N2H4(l) ΔH=a kJ·mol-1,该反应不能自发进行,则a 0(填“>”、“<”或“=”).
(2)ZnS焙烧的反应2ZnS+3O2 2SO2+2ZnO所涉及的物质中,发生氧化反应的物质是 ,不含离子键的化合物是 .
2SO2+2ZnO所涉及的物质中,发生氧化反应的物质是 ,不含离子键的化合物是 .
(3)电解过程中析出锌的电极反应式为___________________________.
(4)产生的SO2可用Ba(NO3)2溶液吸收,部分产物可作为工业原料,其反应的离子方程式为 .
(5)锌-空气电池与锂电池相比,具有储存电量高、成本低、没有安全隐患等优点。该电池的总反应为2Zn+O2===2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为 。25℃时,以该电池为电源,用两个等质量的铜棒作电极电解500 mL 0.1mol/L CuSO4溶液,一段时间后切断电源,对电极干燥并称量,测得两电极的质量差为9.6 g,则至少需要________L空气(折算成标准状况)进入该电池。