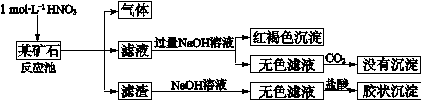
某铝合金中含有铁、铝、镁、铜、硅。为了测定该合金中铝的含量,现设计了如下实验:
已知:Si+2NaOH+H2O=Na2 Si O3+2H2↑,H2Si O3是不溶于水的弱酸。
(1)固体A的成分是:____________,溶液M中的阴离子有:____________________
(2)步骤③中生成沉淀的离子方程式为:_____________________________________
(3)步骤④中,用到的仪器有三脚架、酒精灯以及
(4)在空气中将NaOH溶液滴入FeCl2溶液中,观察到的现象是 ,反应的化学方程式是 ,
(5)该样品中铝的质量分数是:_______________________________(用a、b表示)。
(6)下列因操作不当,会使测定结果偏大的是___________
| A.第①步中加入NaOH溶液不足 | B.第②步中加入盐酸不足时 |
| C.第④步中的沉淀未用蒸馏水洗涤 | D.第④步对沉淀灼烧不充分 |


 Si3N4(s) + 12 HCl(g) △H<0
Si3N4(s) + 12 HCl(g) △H<0 O2(g)=== CO(g) ΔH2 =-110 kJ·mol-1
O2(g)=== CO(g) ΔH2 =-110 kJ·mol-1 粤公网安备 44130202000953号
粤公网安备 44130202000953号