四川省乐山市高三第一次调查研究考试理综化学试卷
下列说法正确的是
| A.从海水提取物质都必须通过化学反应才能实现 |
| B.“地沟油”经过加工处理后,可以用来制肥皂和生物柴油 |
| C.“绿色化学”的核心是利用化学原理进行环境治理 |
| D.生石灰、铁粉、硅胶是食品包装中常用的干燥剂 |
用NA表示阿伏加德罗常数的数值,下列说法中正确的是
| A.在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.3 NA |
| B.22.4L NH3中含有的原子总数为4NA |
| C.1mol单质钠在常温下或点燃条件下与O2完全反应转移的电子数都为NA |
| D.常温条件下,等物质的量浓度的HCl溶液和NaOH溶液混合,溶液pH=7 |
下列说法中不正确的是
| A.NaOH溶液和AlCl3溶液相互滴加的现象不同 |
| B.向淀粉碘化钾溶液中加溴水,溶液变为蓝色,说明Br2的氧化性强于I2 |
| C.氧化铁和氧化亚铁都是碱性氧化物,和硝酸反应都只生成盐和水 |
| D.NH4Cl和HCl溶于水后滴加石蕊都变红色,说明溶液中c(H+)>c(OH—) |
下列离子方程式书写正确的是
| A.Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑ |
B.向 NaHSO4溶液中滴加Ba(OH)2溶液至中性: H++SO +Ba2++OH- +Ba2++OH- BaSO4↓+H2O BaSO4↓+H2O |
| C.用氯化铁溶液腐蚀铜板:Cu+Fe3+===Cu2++Fe2+ |
| D.用烧碱溶液吸收氯气:Cl2+2OH-==Cl-+ClO-+H2O |
甲、乙、丙、X是中学化学中常见的4种物质,其转化关系符合图。
其中甲和X不可能是
| A.甲为Fe,X为Cl2 |
| B.甲为SO2,X为NaOH溶液 |
| C.甲为C,X为O2 |
| D.甲为AlCl3溶液,X为NaOH溶液 |
仅用下表提供的实验器材和药品,就能达到相应实验目的的是
| 编号 |
实验器材 |
实验药品 |
实验目的 |
| A |
托盘天平(带砝码)、100mL容量瓶、量筒、烧杯、药匙、玻玻棒 |
NaCl固体、蒸馏水 |
配制100 mL一定物质的量浓度的NaCl溶液 |
| B |
大试管、长颈漏斗、有孔塑料板、导管及橡皮塞、集气瓶、玻璃片、火柴 |
稀盐酸、块状石灰石 |
制取并收集二氧化碳气体 |
| C |
碱式滴定管、酸式滴定管、胶头滴管、铁架台(带铁夹)、锥形瓶 |
己知浓度的NaOH溶液、待测盐酸、蒸馏水、白纸 |
测定稀盐酸的物质的量浓度 |
| D |
铁架台(带铁夹)、酒精灯、大试管、集气瓶、导管及橡皮塞 |
氯化铵 |
制取并收集氨气 |
有Al、CuO、Fe2O3组成的混合物共10.0 g,放入500 mL某浓度的盐酸溶液中,混合物完全溶解,当再加入250 mL 2.0 mol/L的NaOH溶液时,得到的沉淀最多。上述盐酸溶液的浓度为
| A.0.5 mol/L | B.1.0 mol/L |
| C.2.0 mol/L | D.3.0 mol/L |
A、B、C是短周期非金属元素,核电荷数依次增大。A原子外围电子排布为ns2np2,C是地壳中含量最多的元素。D、E是第四周期元素,其中D原子核外未成对电子数在同周期中最多。E原子最外层只有1个电子,其余各层均排满。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)分子(AB)2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为 ,1mol该分子中含有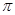 键的物质的量为 。
键的物质的量为 。
(3)基态D原子的外围电子排布式为 。DO2Cl2熔点:-96.5℃,沸点:117℃,则固态DO2Cl2属于 晶体。
(4)E的氢化物的晶胞结构如图所示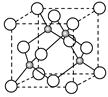
其化学式是 。
某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH、Cl-、CO、SO,现分别取100 mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02 mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、干燥、灼烧后,得到1.02 g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65 g固体。
依据实验回答下列问题:
(1)由①可知一定存在的离子为 ,其浓度为 mol·L-1。
(2)写出②中产生沉淀的离子方程式 。
(3)由③可知一定存在的离子为 ,其浓度为 mol·L-1。
(4)综合上面三个实验,该混合物的水溶液中一定不存在的离子是 (填离子符号)。
(5)某同学通过分析认为该溶液中一定存在K+,他的理由是 。
通过煤的气化和液化,使碳及其化合物得以广泛应用。
I.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向1L恒容密闭容器中充人CO和H2O(g),800℃时测得部分数据如下表。
| t/min |
0 |
1 |
2 |
3 |
4 |
| n(H2O)/mol |
0.600 |
0.520 |
0.450 |
0.350 |
0.350 |
| n(CO)/mol |
0.400 |
0.320 |
0.250 |
0.150 |
0.150 |
则该温度下反应的平衡常数K= 。
(2)相同条件下,向2L恒容密闭容器中充入1molCO、1mol H2O(g)、2molCO2、2mo1 H2,
此时υ(正) υ(逆) (填“>” “="”" 或 “<”)。
II.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283 kJ·mol-1、286 kJ·mol-1、726 kJ·mol-1'。
(3)利用CO、H2合成液态甲醇的热化学方程式为 。
(4)依据化学反应原理,分析增加压强对制备甲醇反应的影响 。
III。为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:
一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2—。
(5)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式 。
(6)已知一个电子的电量是1.602×10—19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH g。
Ⅳ.煤燃烧产生的CO2是造成温室效应的主要气体之一。
(7)将CO2转化成有机物可有效地实现碳循环。如:
a.6CO2+6H2O C6H12O6+6O2
C6H12O6+6O2
b.2CO2 + 6H2 C2H5OH +3H2O
C2H5OH +3H2O
c.CO2 + CH4 CH3COOH
CH3COOH
d.2CO2 + 6H2 CH2=CH2 + 4H2O
CH2=CH2 + 4H2O
以上反应中,最节能的是 ,反应c中理论上原子利用率为 。
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图所示装置模拟工业制取并收集ClO2。
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式: 。
(2)A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、 ;B也必须添加温度控制装置,应该是 (选填“冰水浴”或“热水浴”)装置。
(3)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据下图所示的NaClO2的溶解度曲线,
请补充从NaClO2溶液中制得NaClO2的操作步骤:① ;② ;③洗涤;④干燥。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol·L—1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知2 Na2S2O3 + I2= Na2S4O6 + 2NaI)
①滴定过程中,至少须进行两次平行测定的原因是 。
②原ClO2溶液的浓度为 g / L(用步骤中的字母代数式表示)。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号