(7分)向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
(1)写出反应的离子方程式__________________________________________;
(2)下列三种情况下,离子方程式与(1)相同的是________(填序号)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至 恰好完全沉淀
恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀H2SO4直至过量,整个过程中混合溶液中的导电能力(用电流强度I表示)可近似地用右图中的曲线表示是________(填序号).
有一工业废水,其中含有少量Fe2+、Ag+、Na+和SO42—。试设计一个实验方案,回收Ag并获得FeSO4·7H2O。请填写下表。
现有下列十种物质:①液态HCl ②NaHCO3 ③NaCl溶液 ④CO2 ⑤蔗糖晶体 ⑥Ba(OH)2 ⑦红褐色的氢氧化铁胶体 ⑧NH3·H2O ⑨空气 ⑩Al2(SO4)3
(1)上述十种物质中有两种物质在水溶液中可发生反应,离子方程式为:H++OH- H2O,该反应的化学方程式为 。
H2O,该反应的化学方程式为 。
(2)⑩在水中的电离方程式为 ,
(3)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能治疗胃酸过多,请写出其反应的离子方程式: ;如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,此时最好用含Al(OH)3的胃药(如胃舒平),它与胃酸反应的离子方程式:
(4)向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
①写出反应的离子方程式 。
纳米ZnS具有独特的光电效应,在电学、磁学、光学等领域应用广泛。以工业废渣锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:
请回答下列问题。
(1)酸浸时FeO与稀HNO3反应的离子方程式 。
(2)将酸浸的尾气循环利用,加入的X气体可以是 。
(3)流程中加入ZnO调pH的目的是 。
(4)滤渣2中的成分是 。
(5)已知ZnS的溶度积Ksp=1.6×10-24,溶液中Zn2+浓度为0.01mol·L-1,则溶液中S2—浓度大于 mol·L一1,才生成ZnS沉淀。
(6)试设计简单实验方案,判断所得ZnS样品颗粒是否为纳米级 。
氧化还原反应在工农业生产和日常生活中有广泛运用。
(1)罐头厂在装食物罐头时通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类防腐剂应具有 。(填“氧化性”或“还原性”);
(2)铁是生物体中不可缺少的微量元素,铁在人体中是以Fe2+和Fe3+的形式存在的,Fe2+更容易被吸收。服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中维生素C所起的作用是 。(填“氧化作用”或“还原作用”);
(3)缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式,而硫酸铁则无这种药效。用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是 。
(4)在下列的空白处填写最适宜的除杂试剂,并写出相应的离子方程式
①FeCl2中含少量FeCl3杂质 , 。
②FeCl3中含少量FeCl2杂质 , 。
③FeSO4中含少量CuSO4 杂质 , 。
湿法炼锌的冶炼过程可用下图简略表示:
请回答下列问题:
(1)已知:N2(g)+2H2(g)===N2H4(l) ΔH=a kJ·mol-1,该反应不能自发进行,则a 0(填“>”、“<”或“=”).
(2)ZnS焙烧的反应2ZnS+3O2 2SO2+2ZnO所涉及的物质中,发生氧化反应的物质是 ,不含离子键的化合物是 .
2SO2+2ZnO所涉及的物质中,发生氧化反应的物质是 ,不含离子键的化合物是 .
(3)电解过程中析出锌的电极反应式为___________________________.
(4)产生的SO2可用Ba(NO3)2溶液吸收,部分产物可作为工业原料,其反应的离子方程式为 .
(5)锌-空气电池与锂电池相比,具有储存电量高、成本低、没有安全隐患等优点。该电池的总反应为2Zn+O2===2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为 。25℃时,以该电池为电源,用两个等质量的铜棒作电极电解500 mL 0.1mol/L CuSO4溶液,一段时间后切断电源,对电极干燥并称量,测得两电极的质量差为9.6 g,则至少需要________L空气(折算成标准状况)进入该电池。
某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH、Cl-、CO、SO,现分别取100 mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02 mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、干燥、灼烧后,得到1.02 g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65 g固体。
依据实验回答下列问题:
(1)由①可知一定存在的离子为 ,其浓度为 mol·L-1。
(2)写出②中产生沉淀的离子方程式 。
(3)由③可知一定存在的离子为 ,其浓度为 mol·L-1。
(4)综合上面三个实验,该混合物的水溶液中一定不存在的离子是 (填离子符号)。
(5)某同学通过分析认为该溶液中一定存在K+,他的理由是 。
某铝合金中含有铁、铝、镁、铜、硅。为了测定该合金中铝的含量,现设计了如下实验:
已知:Si+2NaOH+H2O=Na2 Si O3+2H2↑,H2Si O3是不溶于水的弱酸。
(1)固体A的成分是:____________,溶液M中的阴离子有:____________________
(2)步骤③中生成沉淀的离子方程式为:_____________________________________
(3)步骤④中,用到的仪器有三脚架、酒精灯以及
(4)在空气中将NaOH溶液滴入FeCl2溶液中,观察到的现象是 ,反应的化学方程式是 ,
(5)该样品中铝的质量分数是:_______________________________(用a、b表示)。
(6)下列因操作不当,会使测定结果偏大的是___________
| A.第①步中加入NaOH溶液不足 | B.第②步中加入盐酸不足时 |
| C.第④步中的沉淀未用蒸馏水洗涤 | D.第④步对沉淀灼烧不充分 |
(本题3个空,每空2分,共6分)
在盛有100mL浓硝酸的试管中加入32g铜片发生反应。请回答:
(1)开始阶段,反应的离子方程式是 。
(2)若二者恰好完全反应,共产生气体11.2L(标准状况)。则浓硝酸的物质的量浓度为 。
(3)反应结束后的试管中,再加入金属铜和入少量20%的稀硫酸,这时溶液中又有气泡产生,请写出反应的离子方程式是 。
A、B、C、D、F属于元素周期表中的短周期元素,并且其中只有一种金属元素。A是元素周期表所有元素中原子半径最小的;B和C原子都只有两个电子层,B原子的一个电子层了电子数是另一层的两倍;C的原子的两层电子数之和是两层电子数之差的两倍;D原子的一个电子层的电子数是另两层电子数之和;E的+1价阳离子与C的阴离子有相同的电子层结构。请按要求同答下列问题:
(1)D元素在元素周期表中的位置是 ,写出由A和C组成的原子个数比为1:1的化合物的电子式 。
(2)由上述元素组成的化合物中属于直线型分子是 (只要求写出两种,用化学式表示)。
(3)上述元素形成的化合物中通常能污染空气的是 (至少写出两种),其中有两种污染物有同种元素并能相互反应,该反应的化学方程式为 。反应中氧化产物与还原产物的物质的量之比是 。
(4)写出由B、C、E三种元素组成两种氧化物互相反应有气体生成的化学方程式 ;
(5)由A、B、C、E四种元素形成的化合物的水溶液与过量石灰水反应的离子方程式是: 。
中共十八大报告提出:“大力推进生态文明建设”。
① 燃煤是增加大气PM2.5数值,形成雾霾天气的罪魁祸首之一。煤的气化是高效、清洁地利用煤炭的重要途径,写出灼热的焦炭与水蒸气反应的化学方程式 。
② 餐饮业产生的“地沟油”的主要成分是油脂。综合利用“地沟油”的一种方法是将“地沟油”中的油脂水解以获取高级脂肪酸和 (填名称)。将废弃塑料进行 处理,可以获得乙烯、丙烯等化工原料。
③ 防治重金属污染是2013年全国环保工作的重点。向含有Hg2+的废水中加入Na2S,可以使Hg2+转变成沉淀,离子反应方程式为 。
④ 我国生活垃圾一般可分为以下四大类:可回收垃圾、厨余垃圾、有害垃圾和其他垃圾。以下物质属于可回收垃圾的是 (填字母)。
a. 废报纸 b. 废铝制易拉罐 c. 过期药品 d. 渣土
X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的三倍,Z与X原子最外层电子数相同。回答下列问题:
(1)X、Y和Z的元素符号分别为 、 、 。
(2)由上述元素组成的化合物中,既含有共价键又含有离子键的有 、 。
(3)X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的物质的电子式为___________此化合物在酸性条件下与高锰酸钾反应的离子方程式为 ;此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为 。
向200 mL 某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液。向上述所得溶液中,逐滴滴加2 mol·L-1的盐酸,所得气体的体积与所加盐酸的体积关系如图所示: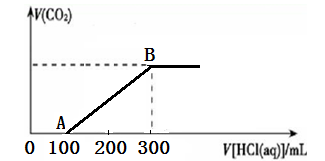
(1)OA段、AB段发生反应的离子方程式__________________、__________________。
(2)B点时,反应所得溶液中溶质的物质的量浓度是______________。