(7*1分)某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:
(1)操作①的名称是 ,操作②的名称是 。
(2)试剂a是 ,试剂b是 ,固体B是 。(填化学式)
(3)加入试剂a所发生的离子方程式为: 。
加入试剂b所发生的离子方程式为: 。
(10分)向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式_____________________________。
(2)下列三种情况下,离子方程式与(1)相同的是______(填序号)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
若在A项所得溶液中,继续滴加Ba(OH)2溶液,此步反应的离子方程式为: 。
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用下图1中的 曲线表示(填序号)。
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如下图2所示,向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将 。


图1 图2
(4*2分)写出下列反应的离子方程式:
(1)氢氧化钠与硫酸反应 ;
(2)实验室制取CO2气体 ;
(3)少量CO2气体通入澄清石灰水 ;
(4)硫酸铜溶液与氢氧化钠反应 。
现有下列电解质溶液:
①Na2CO3 ②NaHCO3 ③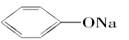 ④CH3COONH4 ⑤NH4HCO3
④CH3COONH4 ⑤NH4HCO3
(1)在这五种电解质溶液中,既能与盐酸又能与烧碱溶液反应的是(填写序号)________。
(2)已知酸性:H2CO3>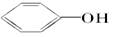 >
>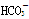 。常温下,物质的量浓度相同的①②③溶液,pH由大到小顺序为(填序号)________>________>________。
。常温下,物质的量浓度相同的①②③溶液,pH由大到小顺序为(填序号)________>________>________。
(3)写出⑤与足量NaOH溶液混合加热反应的离子方程式: __________________________________________________________________。
(4)已知常温下CH3COONH4溶液呈中性,根据这一事实推测⑤溶液的pH________7(填“>”“=”或“<”),理由是________________________。
(12分,每空3分)已知A为金属单质,C为一种强碱。它们有以下相互转化。试回答:
(1)写出B的化学式 ,D的化学式 。
(2)写出由D转变成H的化学方程式 。
(3)写出向G溶液加入A的有关离子反应方程式 。
(16分)“探险队员”——盐酸,不小心走进了化学迷宫,迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。

(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线)_____________。
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有__________个,属于氧化还原反应的有__________个,其中能“吃掉”盐酸的盐是__________(填写物质序号)。
(3)在不能“吃掉”盐酸的物质中,属于非电解质的是________(填写物质序号),在能“吃掉”盐酸的物质中,属于电解质的是 (填写物质序号)。
(4)如果将盐酸换成碳酸镁,它能沿着盐酸走出的路线“走出”这个迷宫吗?填“能”或“不能”_____,写出离子方程式说明其原因: 。
按要求完成下列化学用语:
(1)NaHSO4的电离方程式: ,
(2)CuSO4溶液和NaOH溶液反应的离子方程式: ,
(3)能用H++OH-=H2O表示的一个化学方程式: 。
(12分)已知实验室制取C12的反应为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,又已知Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,也能氧化浓盐酸生成C12;
MnCl2+Cl2↑+2H2O,又已知Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,也能氧化浓盐酸生成C12;
(1)写出PbO2与浓盐酸反应的化学方程式 ,其中表现还原性的HCl与表现酸性的HCl的物质的量之比为 。
(2)PbO2不稳定,随温度升高按下列顺序逐步分解:PbO2→Pb2O3→Pb3O4→PbO。若加热分解后所得到的固体全部为Pb3O4,现将a molPbO2加热分解,则加热过程中放出O2__ ___L(标准状况下);
(3)已知PbSO4不溶于水,但可溶于醋酸铵溶液,反应方程式如下:PbSO4+2CH3COONH4= (CH3COO)2Pb+(NH4)2SO4。
①PbSO4与CH3COONH4能进行反应的原因是符合了复分解反应条件之一的生成了 ,现将Na2S溶液与醋酸铅溶液混合有沉淀生成,则其反应的离子方程式应为 。
②已知+2价Sn的化合物具有强还原性。等物质的量的PbO2和SnO的混合物溶于过量的稀硫酸中,溶液中存在的主要金属阳离子是 (填序号)。
| A.Pb2+ | B.Pb4+ | C.Sn2+ | D.Sn4+ |
钾水玻璃以其优异的性能广泛用于防腐、铸造、油田、钻井或各种高档涂料中。钾水玻璃中硅含量的测定可以采用氟硅酸钾容量法,其步骤为:
①称取试样溶解在含有过量的氟离子和钾离子的强酸溶液中,硅能与氟离子、钾离子作用生成氟硅酸钾(K2SiF6)沉淀;
②沉淀分离后于热水中水解,生成HF、H2SiO3、KF;
③过滤除去硅酸沉淀,用氢氧化钠标准溶液滴定滤液。
(1)上述步骤②中的水解反应方程式为 ;
步骤③中反应的离子方程式为: 。
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得的硅元素含量将 (填“偏高”、或“偏低”或“不变”)。
(3)若每次称取试样的质量为1.00g,重复滴定四次,消耗1.00 mol·L-1氢氧化钠标准溶液的体积为分别为16.80mL、19.90mL、20.00mL、20.10mL,试计算该试样中硅元素的质量分数(以二氧化硅计),写出计算过程。
氧化还原反应在工农业生产和日常生活中有广泛运用。
(1)罐头厂在装食物罐头时通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类防腐剂应具有 。(填“氧化性”或“还原性”);
(2)铁是生物体中不可缺少的微量元素,铁在人体中是以Fe2+和Fe3+的形式存在的,Fe2+更容易被吸收。服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中维生素C所起的作用是 。(填“氧化作用”或“还原作用”);
(3)缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式,而硫酸铁则无这种药效。用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是 。
(4)在下列的空白处填写最适宜的除杂试剂,并写出相应的离子方程式
①FeCl2中含少量FeCl3杂质 , 。
②FeCl3中含少量FeCl2杂质 , 。
③FeSO4中含少量CuSO4 杂质 , 。
现有下列十种物质:① O2 ② Fe ③ CaO ④CO2 ⑤ H2SO4 ⑥ Ba(OH)2 ⑦红褐色的氢氧化铁胶体 ⑧硫酸钠溶液 ⑨稀硝酸 ⑩Cu2(OH)2CO3.
(1)按物质的树状分类法填写表格的空白处:
| 分类标准 |
 |
氧化物 |
|
胶体 |
| 属于该类的物质 |
② |
|
⑧ ⑨ |
|
(2)上述物质属于非电解质的有 ;上述物质能与盐酸反应的电解质有 (填序号)。
(3)上述十种物质中有两种物质之间可发生离子反应:H++OH-= H2O,该离子反应对应的化学反应方程式为__ ________________________________________________________。
(4) 过量的②与⑨发生化学反应的化学方程式为:3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O,该反应的还原剂是 (填化学式),当生成0.05mol的NO气体时,转移的电子的物质的量为__________。
某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH、Cl-、CO、SO,现分别取100 mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02 mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、干燥、灼烧后,得到1.02 g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65 g固体。
依据实验回答下列问题:
(1)由①可知一定存在的离子为 ,其浓度为 mol·L-1。
(2)写出②中产生沉淀的离子方程式 。
(3)由③可知一定存在的离子为 ,其浓度为 mol·L-1。
(4)综合上面三个实验,该混合物的水溶液中一定不存在的离子是 (填离子符号)。
(5)某同学通过分析认为该溶液中一定存在K+,他的理由是 。
某铝合金中含有铁、铝、镁、铜、硅。为了测定该合金中铝的含量,现设计了如下实验:
已知:Si+2NaOH+H2O=Na2 Si O3+2H2↑,H2Si O3是不溶于水的弱酸。
(1)固体A的成分是:____________,溶液M中的阴离子有:____________________
(2)步骤③中生成沉淀的离子方程式为:_____________________________________
(3)步骤④中,用到的仪器有三脚架、酒精灯以及
(4)在空气中将NaOH溶液滴入FeCl2溶液中,观察到的现象是 ,反应的化学方程式是 ,
(5)该样品中铝的质量分数是:_______________________________(用a、b表示)。
(6)下列因操作不当,会使测定结果偏大的是___________
| A.第①步中加入NaOH溶液不足 | B.第②步中加入盐酸不足时 |
| C.第④步中的沉淀未用蒸馏水洗涤 | D.第④步对沉淀灼烧不充分 |
写出下列反应的离子方程式。
(1)用稀硫酸清洗铁锈(Fe2O3)_____________________________________
(2)碳酸钠溶液与盐酸混合___________________________________________
(3)硫酸铜溶液和氢氧化钡溶液混合_____________________________
(4)向足量澄清石灰水中通入二氧化碳________________________