海带中含有丰富的碘。为了从海中提取碘,某研究性学习小组设计并进行了以下实验:
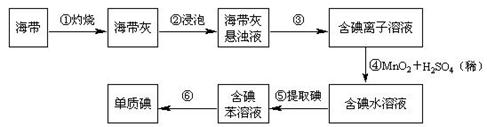
现有下列仪器,请按要求填写以下空白:
(1)其中适用于物质分离的仪器有______________(填名称),使用前需要检验是否漏水的有(填序号)。
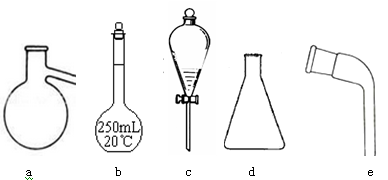
(2)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
| A.烧杯 |
B.坩埚 |
C.表面皿 |
D.泥三角 E.酒精灯 F.干燥器 |
(3)步骤③除铁架台、烧杯外,还需用到的仪器有;
(4)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是,上图中还缺少的玻璃仪器是。
(5)步骤⑤中某学生选择用苯来提取碘的理由是。