铁和铜是生活中两种常见的金属材料,某同学查阅资料得知铁主要是由铁矿石经热还原的方法冶炼的,常见的铁矿石有磁铁矿、赤铁矿、黄铁矿(主要成分为FeS2)等。
(1)赤铁矿的主要成分为__________(填化学式),工业上用一氧化碳还原赤铁矿冶炼铁的化学反应方程式为________________;
(2)从矿物资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4;(已知FeS2中Fe显+2价)
该反应中氧化剂是_____(填化学式),当有5molFeS2发生反应时,电子转移数为________;
(3)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,用FeCl3溶液作“腐蚀液”,请写出刻制过程的离子方程式__________________。
已知H2CO3的Ka1=4.2×10-7、Ka2=5.6×10-11;HClO的Ka="3.0×" 10-8,
HF的Ka=3.5×10-4。
(1)NaClO溶液中通入少量CO2发生反应的离子方程式为 。
(2)在饱和氯水中加入NaHCO3,直至溶液的黄绿色褪去,则发生反应的离子方程式为 。
(3)常温下,将pH和体积都相同的氢氟酸和次氯酸分别加蒸馏水稀释,pH随溶液体积变化如图所示。

①曲线Ⅰ为 稀释时pH的变化曲线。
②取A点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗 体积较小。
(4)25 ℃时,将0.40 mol·L-1 HCN溶液与0.20 mol·L-1 NaOH溶液各100 mL混合后,测得溶液的pH=a(a>7)。则该溶液中所有离子浓度大小关系为 ;
c(HCN)-c(CN-)= mol·L-1。(假设混合后体积等于两种溶液体积之和)
由A元素组成的一种单质是重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料,C与烧碱反应生成含A元素的化合物D。
(1)列举化合物D的两种用途:_____________。
(2)下列物质的主要成分为C的有_____________(填字母)。
a.沙子 b.水玻璃 c.黏土 d.玛瑙
(3)将C与纯碱混合,高温熔融时也能发生反应生成D,同时还生成B元素的最高价氧化物E;将E通入足量D的水溶液中,又发生反应生成含A元素的化合物F。
①C与纯碱混合高温熔融时发生反应的化学方程式为__________________________。
②E与足量D的水溶液反应的离子方程式为_____________。
(本题共10分)
利用镁和稀硫酸反应,不仅可以测定1mol氢气的体积,装置如下左图,也可以测定镁带中镁的质量分数(杂质与酸反应不产生气体),装置如下右图。

32.用离子方程式表示测定实验的反应原理 。
按要求书写下列反应的离子方程式
(1)CuSO4溶液与过量Ba(OH)2溶液反应:
(2)Al2(SO4)3溶液中加入过量氨水:
(3)将过量SO2气体通入冷氨水中:
(4)向NaAlO2溶液中通入过量CO2:
(5)0.01 mol·L-1 NH4Al(SO4)2溶液与0.02 mol·L-1 Ba(OH)2溶液等体积混合:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层,铅在元素周期表的位置为 ,四氧化三铁可写成FeO·Fe2O3 的形式,如果将Pb3O4也写成相对应的形式应为: 。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为: 。
PbO2可有PbO与次氯酸钠溶液反应制得,其反应的离子方程式为 。
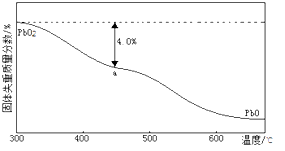
(3)PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0%(即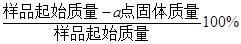 )的残留固体,若a点固体组成表示为PbO2或mPbO2 ·nPbO,计算x值和m:n , 。
)的残留固体,若a点固体组成表示为PbO2或mPbO2 ·nPbO,计算x值和m:n , 。
现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题。
(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。主要反应为:
2ZnS +3O2 2ZnO+2SO2;鼓风炉中:2C +O2
2ZnO+2SO2;鼓风炉中:2C +O2 2CO ZnO+CO
2CO ZnO+CO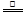 Zn + CO2
Zn + CO2
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2
图1酸度对铟浸出率的影响 图2液固比对铟浸出率的影响
①当酸度为196时,其物质的量浓度为 。
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:_______、_______。
(2)湿法炼锌的主要工艺流程为:

①从保护环境和充分利用原料角度,如何处理或利用烟气 。
②除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式 。
③酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式__________、__________。
按要求填空
Ⅰ除去括号中的杂质,写出所加试剂及反应的离子方程式
(1)Na2SO4(Na2CO3)试剂 ,离子方程式 。
(2)KCl(K2SO4)试剂 ,离子方程式 。
Ⅱ将正确答案填写在横线上
人体血红蛋白分子中含有Fe2+,正是这些Fe2+使血红蛋白分子具有载氧功能。亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+转化为Fe3+,生成高铁血红蛋白而丧失与氧气的结合能力,反应过程中Fe2+发生________反应,说明亚硝酸钠具有________性;误食亚硝酸钠中毒,可服维生素C缓解,说明维生素C具有________性。
硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1。
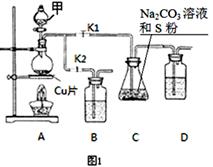
已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)步骤1:打开K1、关闭K2,向圆底烧瓶中加入足量甲并加热,写出反应的方程式: 。
(2)步骤2:始终保持C中溶液呈碱性,反应一段时间后,硫粉的量逐渐减少,打开K2、关闭K1并停止加热。
①C中溶液须保持呈碱性的原因:若呈酸性,则 、 。(用离子方程式表示)
②装置B、D的试剂相同,均为 。
步骤3:将C中所得混合物分离提纯后得产品。
(3)利用反应2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2也能制备Na2S2O3。所需仪器如图2,按气流方向连接各仪器,接口顺序为:a→____,____→ , → , →d。
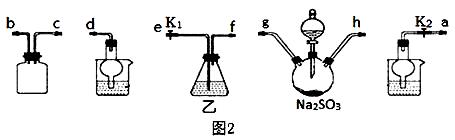
(4)装置乙盛装的试剂是:_____________________________。
(5)Na2S2O3还原性较强,工业上常用作除去溶液中残留的Cl2,该反应的离子方程式为 。
(6)请设计简单的实验方案,证明上述残留的Cl2被还原成了Cl—:____________
(1)质量相同的O2、NH3、H2、Cl2四种气体中,在相同温度和相同压强条件下,体积最大的是 。
(2)下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是 。(填序号)
①NaAlO2 ②Ca(OH)2 ③Na2CO3 ④Al(OH)3 ⑤NaHCO3 ⑥Si
(3)氯水中含有多种成分。将紫色石蕊试液滴入氯水中,溶液显红色起作用的成分是 ;过一会儿,溶液颜色逐渐褪去,起作用的成分是 ;
(4)已知:Fe2+的还原性强于Br—,标准状况下把11.2L氯气通入500ml 0.8mol/L FeBr2溶液中,写出反应完全后的离子方程式 。
在铝质易拉罐中收集满CO2气体,然后在其中倒入10mL浓NaOH溶液,并迅速用胶带将易拉罐口封住,能够观察到的实验现象是易拉罐突然变瘪了,可经过一段时间之后,又可以观察到的现象是 ,试解释易拉罐变瘪的原因 ,并解释后一现象的原因 ,写出反应过程中的两个离子方程式 、 。
一瓶溶液里可能含有K+,OH-,Cl-,NO3-,CO32-,SO42-等离子中的某几种,现分别取两等份该溶液分装于两支试管里,做以下实验:
(1)向第一支试管里滴入酚酞试液,溶液变红色。
(2)第二支试管里加入足量Ba(NO3)2溶液,产生白色沉淀19.7克,过滤后并将滤液移入第三支试管,向沉淀中加入稀硝酸,沉淀逐渐消失,并有无色气体产生,该气体通入澄清石灰水,立即产生混浊。
(3)向第三支试管中加入足量的稀硝酸,再滴加少量AgNO3溶液,无现象。
(4)经测定,第一支试管溶液中含K+0.3mol,OH-0.05mol。
根据实验,判断溶液中肯定含有的阴离子有(用离子符号表示)__________,一定不含的离子有(用离子符号表示)__________。写出⑵中加入Ba(NO3)2溶液,产生的白色沉定的化学式: ,该沉淀溶于硝酸溶液的离子方程式: 。
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(以下数据和实验均指在25℃下测定)
| 难溶电解质 |
CaCO3 |
CaSO4 |
| Ksp |
2.8×10-9 |
9×10-6 |
实验步骤如下:
①往100 mL 0.1 mol·L-1的CaCl2溶液中加入100 mL 0.1 mol·L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入足量Na2CO3 固体,搅拌,静置,沉淀后弃去上层清液.
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液.
④________________________。
(1)步骤①所得悬浊液中c(Ca2+)=________ mol·L-1
(2)写出第②步发生反应的离子方程式:_______________________
(3)请补充第④步操作及发生的现象___________________________
(4)请写出该原理在实际生产生活中的一个应用________________________
(5分)向盛有1 mL 0.1 mol/L MgCl2溶液的试管中滴加1~2滴2 mol/L NaOH溶液,观察到有白色沉淀生成,该反应的离子方程式是________________。再滴加2滴0.1 mol/L FeCl3溶液,观察到白色沉淀转化为红褐色沉淀,该反应的离子方程式是___________________。由以上现象可以推知,相同条件下Mg(OH)2和Fe(OH)3中溶解度较大的是_________________。
实验室常用NaOH溶液和氨水(NH3·H2O)两种碱溶液来制取不同的金属氢氧化物,请选择合适的试剂来制取以下的金属氢氧化物:
(1)要制取Fe(OH)3时,可用NaOH溶液与__________(写化学式)反应,所得到的沉淀为________色,离子方程式为:____________。
(2)要制取Fe(OH)2时,可用NaOH溶液与__________(写化学式)反应,所得到的沉淀为________色,离子方程式为:____________。
(3)要制取Cu(OH)2时,可用NaOH溶液与__________(写化学式)反应,所得到的沉淀为________色,离子方程式为:____________。
(4)要制取Al(OH)3时,可用氨水与__________(写化学式)反应,所得到的沉淀为________色,离子方程式为:____________。