工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料--铁红(Fe2O3),具体生产流程如下: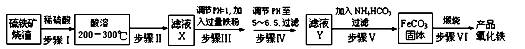
试回答下列问题:
(1)“酸溶”过程中Fe3O4发生反应的离子反应方程式为_________________;
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有_______、玻璃棒和烧杯等;步骤Ⅳ中应选用______试剂调节溶液的pH(填字母编号).
| A.稀硝酸 | B.氢氧化钠溶液 | C.高锰酸钾溶液 | D.氨水 |
(3)检验步骤Ⅲ已经进行完全的试剂是_______;
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是____________;
(5)步骤Ⅵ中发生反应的化学反应方程式为__________________;
(6)步骤Ⅴ中,FeCO3达到沉淀溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6 mol/L。试判断所得的FeCO3中是否含有Fe(OH)2_____(填“是”或“否”),请通过简单计算说明理由.(已知:Ksp[Fe(OH)2]=4.9×10-17)__________________。
(7)欲测定硫铁矿矿渣中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg,测得该样品中Fe元素的质量分数为___________。
按要求写出下列反应的方程式
(1)工业用石英制取粗硅的反应方程式:_______________________________;
(2)工业用赤铁矿做原料炼铁的反应方程式: ;
(3)金属铝与NaOH溶液反应的离子方程式:_______________________________;
(4)FeSO4溶液中滴加双氧水的离子方程式: ;
(5)酸性条件下, MnO4—被SO2还原为Mn2+的离子方程式:___________________________;
(10分)完成下列离子方程式
(1)Ba(OH)2溶液与(NH4)2SO4溶液混合__________________
(2)Ca(HCO3)2溶液与NaOH溶液反应
①NaOH不足:_________________________
②NaOH过量:_________________________
(3)Ba(OH)2溶液与NaHSO4溶液的反应
①溶液呈中性:_________________________
②此时溶液呈碱性:________________________
取来两份等浓度的NaOH溶液A和B,每份10ml,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,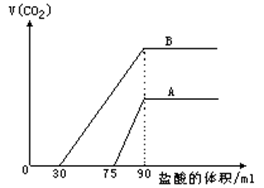
试回答下列问题:
(1)原NaOH溶液的物质的量浓度为 _______________mol/L
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质为(写化学式)___________________;其物质的量之比为_____________。
(3)曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸产生CO2气体体积(标准状况)的最大值为________________ml。
(共10分)
(1)除去NaHCO3溶液中混有的Na2CO3,相应的化学方程式_____________。
(2)除去Na2CO3固体中混有的NaHCO3,相应的化学方程式_____________。
(3)除去CO2气体中混有的HCl,相应的离子方程式___________________。
(4)除去Fe2O3中混有的Al2O3,相应的离子方程式_____________________。
(5)除去FeCl3溶液中混有的FeCl2,相应的离子方程式__________________。
某课题组研究以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺,其设计的流程如下:

回答下列问题:
(1)已知在焙烧硫铁矿石过程中铁元素转化成了Fe3O4,则该反应的化学方程式是 ;
(2)“酸溶”中反应的离子方程式是 ;
(3)“过滤”后滤液中金属阳离子有 ;
(4)“氧化”中使用的氧化剂最好是 ;
用一种试剂除去下列各物质中的杂质(括号内的物质)。写出所用试剂及反应的离子方程式。
(1)BaCl2(HCl):试剂 ,离子方程式 。
(2)O2(CO2):试剂 ,离子方程式 。
(3)SO42-(CO32-):试剂 ,离子方程式 。
(4)Cu粉(Al粉):试剂 ,离子方程式 。
(8分)在分开盛放的A、B两种溶液中,共含有Na+、H+、Ag+、Ba2+、NO3—、Cl—、CO32—七种离子,已知A溶液中含有三种阳离子和一种阴离子,则B溶液中所含的离子是 。取少量A溶液,向其中滴入CaCl2至不再有沉淀生成后,过滤,将此滤液逐滴加入到过量的B溶液中,则滤液中发生的离子反应有 , , 。
在Cl-浓度为0.5 mol·L-1的某无色澄清溶液中,还可能含有下表中的若干种离子。
| 阳离子 |
K+Al3+Mg2+Ba2+ Fe3+ |
| 阴离子 |
NO3-CO32-SiO32-SO42- OH- |
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
| 序号 |
实验内容 |
实验结果 |
| Ⅰ |
向该溶液中加入足量稀盐酸 |
产生白色沉淀并放出标准状况下0.56 L气体 |
| Ⅱ |
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 |
固体质量为2.4 g |
| Ⅲ |
向Ⅱ的滤液中滴加BaCl2溶液 |
无明显现象 |
请回答下列问题。
(1)通过以上实验能确定一定不存在的离子是____ ____。
(2)实验Ⅰ中生成沉淀的离子方程式为___________________________。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子及其浓度(不一定要填满)。
| |
阴离子 |
浓度c/(mol·L-1) |
| ① |
|
|
| ② |
|
|
| ③ |
|
|
| ④ |
|
|
(4)判断K+是否存在,若存在,求出其最小浓度,若不存在说明理由:_____________。
(9分) 向浓度相等、体积均为50 mL的A、B两份KOH溶液中,分别通入一定量的SO2气体后,再稀释到100 mL。
(1)在KOH溶液中通入一定量的SO2气体后,溶液中溶质的组成可能是:
① ;② ;
③ ;④ 。
(2)在稀释后的溶液中逐滴加入0.1 mol/L的盐酸,产生SO2的体积(标准状况)与所加盐酸的体积关系如下图所示。
①A曲线表明,原溶液通入SO2气体后,所得溶质与盐酸反应产生SO2的最大体积是____mL(标准状况)。
②B曲线表明,原溶液通入SO2气体后,所得溶液中溶质的化学式为_________________。
③原KOH溶液的物质的量浓度为________ ____。
X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y的最高正价与最低负价的代数和为2,Z与X原子最外层电子数相同。回答下列问题:
(1)写出Z的离子结构示意图 。
(2)选用以上元素组成一种离子化合物,该化合物为______ 。(写一种即可)
(3)X和Y组成的化合物Q中,既含有极性共价键又含有非极性共价键,Q在空气中点燃时,迅速而安全的燃烧,其反应产物没有任何污染,燃烧时的化学方程式为 _ ;Q还可将酸性工业废水中的Cr2O72—还原为Cr3+,氧化产物为常见气体。相应的离子方程式为 。
有四种物质:①Al2O3、②HNO3、③NaHCO3、④Ba(OH)2。根据要求,回答下列问题:
(1)写出物质④的电离方程式_______________________________。
(2)写出物质②和③反应的离子方程式_______________________________。
(3)既能与强酸反应,又能与强碱反应的物质是____________(填序号)。
按要求填空
(1)硫酸铝(写出电离方程式)
(2)稀硫酸跟氧化镁反应(写出离子方程式)
(3)盐酸跟碳酸氢钠溶液反应(写出离子方程式)
(4)Cu2+ + 2OH—= Cu(OH)2↓(写出化学方程式)
(5)氢氧化铁胶体制备(写出化学方程式)
为建设美丽浙江,浙江省政府开展“五水共治”。
(1)城市饮用水处理时可用二氧化氯(ClO2)替代传统的净水剂Cl2。工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目:_______________。
(2)某地污水中的有机污染物主要成分是三氯乙烯 (C2HCl3),向此污水中加入KMnO4(高锰酸钾的还原产物为MnO2)溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出该反应的化学方程式_________________。