(12分)含有下列离子的五种溶液①Ag+ ②Mg2+ ③Fe2+ ④Al3+ ⑤Fe3+试回答下列问题:
(1)既能被氧化又能被还原的离子是________(填离子符号,下同)。
(2)向③中加入NaOH溶液,现象是_____________ _________________,
有关方程式(是离子反应的写离子方程式)为______ ____________。
(3)加入过量NaOH溶液无沉淀的是_____________。
(4)加入铁粉若溶液质量增重的是______ _,若溶液质量减轻的是_______________。
(5)遇KSCN溶液呈红色的是______________。
(6)能用来鉴别Cl-存在的离子是_______________。
下图是一些中学常见的物质之间的转化关系(其中部分反应产物省略),其中A和B常温下都是气体,且水溶液都有漂白性;I是一种金属单质;F、M、N均为难溶于水的白色沉淀,其中M和N不溶于稀硝酸;C和D是两种常见的强酸。请回答下列问题:
(1)写①的化学方程式______________________________________
(2)写反应②的离子方程式__________________________________
(3)写出将A通入石灰乳的化学方程式________________________
(4)在①②③④⑤⑥中,属于氧化还原反应的有:_______________(填编号)
下图表示的是向Na2CO3溶液中滴入稀盐酸时产生CO2的过程。
(1)写出a点以前发生反应的离子方程式:
(2)写出a到b点发生反应的离子方程式:
(3)若某Na2CO3溶液中含n mol Na2CO3,向其中滴入一定量的稀盐酸,恰好使溶液中Cl-和HCO3-的物质的量之比为2∶1,则滴入的稀盐酸中的HCl的物质的量为 mol(用含n的代数式表示)。
(共10分)
(1)除去NaHCO3溶液中混有的Na2CO3,相应的化学方程式_____________。
(2)除去Na2CO3固体中混有的NaHCO3,相应的化学方程式_____________。
(3)除去CO2气体中混有的HCl,相应的离子方程式___________________。
(4)除去Fe2O3中混有的Al2O3,相应的离子方程式_____________________。
(5)除去FeCl3溶液中混有的FeCl2,相应的离子方程式__________________。
研究工业废弃物的处理和防治具有重要的意义。
(1)利用反应CH4+2NO2 N2+CO2+2H2O可消除NO2的污染,该反应中氧化剂是____,当消耗CH4的体积是11.2 L(标准状况下)时,理论上可处理____molNO2。
N2+CO2+2H2O可消除NO2的污染,该反应中氧化剂是____,当消耗CH4的体积是11.2 L(标准状况下)时,理论上可处理____molNO2。
(2)治理汽车尾气中CO和NO的一种方法是:在汽车排气管中安装一个催化转化装置,该装置能将CO和NO转化为参与大气循环的无毒气体。该反应的化学方程式为________________.
(3)某无色废水中可能含有Fe3+、Al3+、Na+、Cl-、OH-、SO42-、中的几种离子。分别取三份废水进行如下实验:
I.进行焰色反应实验,火焰为无色。
Ⅱ.取100 mL废水,加入足量的BaCl2溶液,生成2.33g白色沉淀。
Ⅲ.取100 mL废水,逐滴加入1.0 mol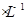 的NaOH溶液,消耗NaOH溶液的体积与生成沉淀的质量如下图所示。
的NaOH溶液,消耗NaOH溶液的体积与生成沉淀的质量如下图所示。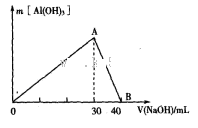
请根据上述信息回答下列问题:、
①该废水中一定不含有的离子是__________.
②实验中需配制1.0 mol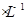 的NaOH溶液100 mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器有_______。
的NaOH溶液100 mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器有_______。
③写出图中A→B反应的离子方程式:_______________________。
④通过计算,该废水中______Cl-(填“含有”或“不含有”);若含有,则c(Cl-)=________(若不含有,此问不必作答)。
(7分)常温下,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L的混合溶液。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示
, , 。
(2)该溶液中,浓度为0.01 mol/L的粒子是 ,浓度为0.002 mol/L的粒子是 。
(3) 和 两种粒子物质的量之和等于0.01 mol。
有四种物质:①Al2O3、②HNO3、③NaHCO3、④Ba(OH)2。根据要求,回答下列问题:
(1)写出物质④的电离方程式_______________________________。
(2)写出物质②和③反应的离子方程式_______________________________。
(3)既能与强酸反应,又能与强碱反应的物质是____________(填序号)。
按要求填空
(1)硫酸铝(写出电离方程式)
(2)稀硫酸跟氧化镁反应(写出离子方程式)
(3)盐酸跟碳酸氢钠溶液反应(写出离子方程式)
(4)Cu2+ + 2OH—= Cu(OH)2↓(写出化学方程式)
(5)氢氧化铁胶体制备(写出化学方程式)
为建设美丽浙江,浙江省政府开展“五水共治”。
(1)城市饮用水处理时可用二氧化氯(ClO2)替代传统的净水剂Cl2。工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目:_______________。
(2)某地污水中的有机污染物主要成分是三氯乙烯 (C2HCl3),向此污水中加入KMnO4(高锰酸钾的还原产物为MnO2)溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出该反应的化学方程式_________________。
现有下列物质:
①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸
⑤FeCl3溶液 ⑥铜 ⑦ Fe(OH)3胶体 ⑧蔗糖,
(1)其中属于电解质的是 ,
(2)写出FeCl3的电离方程式:__________________________,
(3)写出NaHCO3(aq) 与稀盐酸反应的离子方程式:_____________________,
(4)胶体是一种常见的分散系,回答下列问题。
①向煮沸的蒸馏水中逐滴加入饱和FeCl3溶液,继续煮沸至溶液呈红褐色,
停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体化学反应方程式为 。
②向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于_______离子(填离子符号)的作用,使胶体形成了沉淀,这个过程叫做胶体的聚沉。
③区分胶体和溶液常用的方法叫做 。
工业上以废铜为原料经一系列化学反应可生产氯化亚铜(CuCl),其工艺流程如图所示:
试根据如图转化回答下列问题:
(1)工业生产Cl2时,尾气常用石灰乳吸收,而不用烧碱溶液吸收的原因是__________。
(2)还原过程中的产物为Na[CuCl2],试写出反应的化学方程式__________,制备中当氯化完成后必须经还原过程再制得CuCl,为什么不用一步法制得CuCl?(已知Cu2++Cu+2Cl-═2CuCl↓) __________。
(3)还原过程中加入少量盐酸的作用是__________,加入NaCl且过量的原因是__________。
(4)合成结束后所得产品用酒精淋洗的目的是__________。
(5)实验室中在CuCl2热溶液中通入SO2气体也可制备白色的CuCl沉淀,试写出该反应的离子方程式__________。
除去下列物质中的杂质,写出发生反应的离子方程式:
(1)硝酸钾中混有溴化钾___________
(2)碳酸氢钾溶液中混有碳酸钾___________,
(3)二氧化碳气体中混有氯化氢气体___________。
下图表示的是用明矾[KAl(SO4)2·12H2O]制取硫酸铝和硫酸钾的操作流程图,请根据此图回答有关问题。

进行操作②时,加入的试剂是 ,从反应混合物中分离A所进行的实验操作是 ,
其反应的离子方程式为 。
按下列要求填空:
(1)写出过氧化氢和过氧化钠的电子式: 、 。
(2)已知叠氮酸(HN3)是与醋酸酸性相近的酸。写出其在水溶液中电离的方程式: 。
(3)已知水溶液中,YO3n-和3S2-发生反应,离子方程式如下:YO3n-+3S2-+6H+=Y-+3S↓+3H2O,则微粒YO3n-所带的电荷为 。
(4)写出钢铁吸氧腐蚀中正极的电极反应式: 。
(5)在标准状况下,1L水中能溶解a L氯化氢气体,所得溶液密度为ρg/cm3 。请计算出氢化氢的物 质的量浓度(要求化简) 。
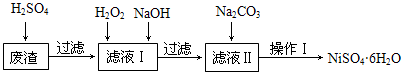
NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Fe、Cr等杂质)为原料获得。工艺流程如下图:
已知:25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表所示。
| |
Fe(OH)2 |
Fe(OH)3 |
Cr(OH)3 |
Ni(OH)2 |
| Ksp |
8.0×10—16 |
4.0×10—38 |
6.0×10—31 |
6.5×10—18 |
| 完全沉淀pH |
≥9.6 |
≥3.2 |
≥5.6 |
≥8.4 |
注:NiCO3是一种不溶于水易溶于强酸的沉淀。
请回答下列问题:
(1)下列措施可行,且能提高废渣浸出率的有 。
A.升高反应温度 B.增大压强 C.在反应过程中不断搅拌
(2)在滤液Ⅰ中加入6%的H2O2,其作用是 (用离子方程式表示);
加入NaOH调节pH的范围是 ,为了除去溶液中的 离子。
(3)滤液Ⅱ的主要成分是 。
(4)检验Ni2+已完全沉淀的实验方法是 。
(5)操作Ⅰ的实验步骤依次为:
① ;
② ;
③蒸发浓缩、冷却结晶,过滤得NiSO4•6H2O晶体;
④用少量乙醇洗涤NiSO4•6H2O晶体并晾干。