现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题。
(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。主要反应为:
2ZnS +3O2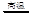 2ZnO+2SO2;鼓风炉中:2C +O2
2ZnO+2SO2;鼓风炉中:2C +O2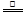 2CO ZnO+CO
2CO ZnO+CO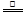 Zn + CO2
Zn + CO2
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2
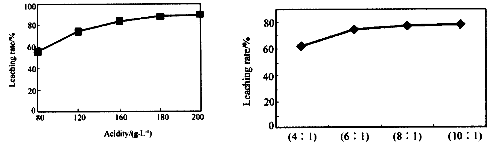
图1酸度对铟浸出率的影响 图2液固比对铟浸出率的影响
①当酸度为196时,其物质的量浓度为 。
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:_______、_______。
(2)湿法炼锌的主要工艺流程为:

①从保护环境和充分利用原料角度,如何处理或利用烟气 。
②除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式 。
③酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式__________、__________。
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下:
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的离子反应方程式为(产物中只有一种酸根) 。请从反应原理分析不用盐酸浸出钴的主要原因____________________________________。
(3)碳酸钠溶液在过程III和IV中所起作用有所不同,请分别用离子方程式表示在过程III、IV中起的作用:__________________________;___________________________。
按要求填空
Ⅰ除去括号中的杂质,写出所加试剂及反应的离子方程式
(1)Na2SO4(Na2CO3)试剂 ,离子方程式 。
(2)KCl(K2SO4)试剂 ,离子方程式 。
Ⅱ将正确答案填写在横线上
人体血红蛋白分子中含有Fe2+,正是这些Fe2+使血红蛋白分子具有载氧功能。亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+转化为Fe3+,生成高铁血红蛋白而丧失与氧气的结合能力,反应过程中Fe2+发生________反应,说明亚硝酸钠具有________性;误食亚硝酸钠中毒,可服维生素C缓解,说明维生素C具有________性。
X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y的最高正价与最低负价的代数和为2,Z与X原子最外层电子数相同。回答下列问题:
(1)写出Z的离子结构示意图 。
(2)选用以上元素组成一种离子化合物,该化合物为______ 。(写一种即可)
(3)X和Y组成的化合物Q中,既含有极性共价键又含有非极性共价键,Q在空气中点燃时,迅速而安全的燃烧,其反应产物没有任何污染,燃烧时的化学方程式为 _ ;Q还可将酸性工业废水中的Cr2O72—还原为Cr3+,氧化产物为常见气体。相应的离子方程式为 。
(12分)某无色溶液中只含有下列8种离子中的某几种:Mg2+、H+、Ag+、Na+、Cl-、HCO3-、OH-、NO3-,已知该溶液能与铝反应且放出的气体只有氢气。试回答下列问题:
(1)若反应后生成Al3+,反应的离子方程式为________________,则原溶液中一定大量存在的离子有________________,一定不能大量存在的离子有__________________。
(2)若反应后生成AlO2-,反应的离子方程式为 ,则溶液中一定大量存在的离子有 ,一定不能大量存在的离子有 。
已知: 2Fe2+ + Br2=2Fe3++2Br-;Cl2+2Br-= Br2+2Cl-
在含n mol FeBr2的溶液中,通入Cl2,有x mol Cl2发生反应。
(1)当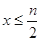 时,反应的离子方程式为_________________________
时,反应的离子方程式为_________________________
(2)当反应的离子方程式为:3Cl2+2Fe2+ +4Br-=2Br2+2Fe3+ +6Cl-时,x与n的关系为_____
(3)当Fe2+和Br-同时被氧化时,x与n的关系是_______________
(4)当x=n时,反应后氧化产物的物质的量为________________
(8分)某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),其实验方案如下:
(1)小组成员经过检测,发现制得的绿矾不纯,最可能的原因是_________________________;要想由沉淀Ⅰ最终制得纯度较高的绿矾,改进方法是__________________________________
(2)小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣B中加入稀硫酸和H2O2可以使B溶解,则该反应的离子方程式为_____________________________________
(3)有同学提出可将方案中最初溶解合金的盐酸改用烧碱,重新设计方案,也能制得这三种物质,该方案比前一种方案相对更合理,原因是:__________________________________
在Cl-浓度为0.5 mol·L-1的某无色澄清溶液中,还可能含有下表中的若干种离子。
| 阳离子 |
K+Al3+Mg2+Ba2+ Fe3+ |
| 阴离子 |
NO3-CO32-SiO32-SO42- OH- |
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
| 序号 |
实验内容 |
实验结果 |
| Ⅰ |
向该溶液中加入足量稀盐酸 |
产生白色沉淀并放出标准状况下0.56 L气体 |
| Ⅱ |
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 |
固体质量为2.4 g |
| Ⅲ |
向Ⅱ的滤液中滴加BaCl2溶液 |
无明显现象 |
请回答下列问题。
(1)通过以上实验能确定一定不存在的离子是____ ____。
(2)实验Ⅰ中生成沉淀的离子方程式为___________________________。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子及其浓度(不一定要填满)。
| |
阴离子 |
浓度c/(mol·L-1) |
| ① |
|
|
| ② |
|
|
| ③ |
|
|
| ④ |
|
|
(4)判断K+是否存在,若存在,求出其最小浓度,若不存在说明理由:_____________。
化学用语是化学学科的特色语言,化学用语可以准确表述化学现象、变化以及本质,请按要求完成以下两个问题。
(1)配平酸性高锰酸钾溶液与过氧化氢溶液反应的离子方程式:
H2O2+ MnO4-+ = Mn2++ O2↑+
(2)化学反应多姿多彩,把SO2通入硝酸铁溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时向溶液中滴加氯化钡溶液,有白色沉淀产生。请写出上述变化中溶液由棕黄色变为浅绿色,但立即又变为棕黄色所涉及的两个离子方程式:____________________、_______________________。
有以下物质:①Mg ②Al ③C ④稀硫酸 ⑤浓硫酸 ⑥NaOH溶液
(1)写出①与④反应的离子方程式 。
(2)既能跟④又能跟⑥反应的是 (填序号),写出它与⑥反应的化学方程式 。
(3)写出写出③与⑤反应的化学方程式 ,下列关于该反应中⑤体现的性质说法正确的是 。
a.既体现氧化性又体现酸性
b.只体现氧化性
c.只体现酸性
d.体现吸水性
有四种物质:①Al2O3、②HNO3、③NaHCO3、④Ba(OH)2。根据要求,回答下列问题:
(1)写出物质④的电离方程式_______________________________。
(2)写出物质②和③反应的离子方程式_______________________________。
(3)既能与强酸反应,又能与强碱反应的物质是____________(填序号)。
按要求填空
(1)硫酸铝(写出电离方程式)
(2)稀硫酸跟氧化镁反应(写出离子方程式)
(3)盐酸跟碳酸氢钠溶液反应(写出离子方程式)
(4)Cu2+ + 2OH—= Cu(OH)2↓(写出化学方程式)
(5)氢氧化铁胶体制备(写出化学方程式)
为建设美丽浙江,浙江省政府开展“五水共治”。
(1)城市饮用水处理时可用二氧化氯(ClO2)替代传统的净水剂Cl2。工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目:_______________。
(2)某地污水中的有机污染物主要成分是三氯乙烯 (C2HCl3),向此污水中加入KMnO4(高锰酸钾的还原产物为MnO2)溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出该反应的化学方程式_________________。
下图表示的是用明矾[KAl(SO4)2·12H2O]制取硫酸铝和硫酸钾的操作流程图,请根据此图回答有关问题。

进行操作②时,加入的试剂是 ,从反应混合物中分离A所进行的实验操作是 ,
其反应的离子方程式为 。