已知铜在常温下能被HNO3溶解,反应方程式为:
3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O
(1)请将上述反应改成离子方程式
___________________________________________________________________
(2)上述反应中,氧化剂是 _____________,氧化产物是_____________。
(3)每2 molCu参加反应,转移的电子__________ 个,在反应的硝酸中没有参加氧化还原反应的硝酸占总硝酸的________________。
(1)(2)题每空1分,(3)(4)小题每空2分,共10分
A、B、C、D、E 5瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3和AgNO3中的一种.已知:
①A与B反应有气体生成;
②B与C反应有沉淀生成;
③C与D反应有沉淀生成;
④D与E反应有沉淀生成;
⑤A与E反应有气体生成;
⑥②和③的反应中生成的沉淀是同一种物质。
请填空:
(1)在②和③的反应中,生成的沉淀物质的化学式(分子式)是___ ___;
(2)A是_______________,B是_______________,C是_______________,
D是_______________,E是_______________。
(3)A 与E 反应的离子方程式是_________________________________________
(4)④中反应的离子方程式是
氧化还原反应在工农业生产和日常生活中有广泛运用。
(1)罐头厂在装食物罐头时通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类防腐剂应具有 。(填“氧化性”或“还原性”);
(2)铁是生物体中不可缺少的微量元素,铁在人体中是以Fe2+和Fe3+的形式存在的,Fe2+更容易被吸收。服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中维生素C所起的作用是 。(填“氧化作用”或“还原作用”);
(3)缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式,而硫酸铁则无这种药效。用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是 。
(4)在下列的空白处填写最适宜的除杂试剂,并写出相应的离子方程式
①FeCl2中含少量FeCl3杂质 , 。
②FeCl3中含少量FeCl2杂质 , 。
③FeSO4中含少量CuSO4 杂质 , 。
完成下列反应的离子方程式:
(1)将AlCl3溶液蒸干得到白色固体: ;
(2)用惰性电极电解饱和食盐水: ;
(3)用KOH做电解质溶液的甲烷燃料电池的负极反应式: ;
(4)往AgCl悬浊液中滴加Na2S溶液: ;
在Cl-浓度为0.5 mol·L-1的某无色澄清溶液中,还可能含有下表中的若干种离子。
| 阳离子 |
K+Al3+Mg2+Ba2+ Fe3+ |
| 阴离子 |
NO3-CO32-SiO32-SO42- OH- |
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
| 序号 |
实验内容 |
实验结果 |
| Ⅰ |
向该溶液中加入足量稀盐酸 |
产生白色沉淀并放出标准状况下0.56 L气体 |
| Ⅱ |
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 |
固体质量为2.4 g |
| Ⅲ |
向Ⅱ的滤液中滴加BaCl2溶液 |
无明显现象 |
请回答下列问题。
(1)通过以上实验能确定一定不存在的离子是____ ____。
(2)实验Ⅰ中生成沉淀的离子方程式为___________________________。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子及其浓度(不一定要填满)。
| |
阴离子 |
浓度c/(mol·L-1) |
| ① |
|
|
| ② |
|
|
| ③ |
|
|
| ④ |
|
|
(4)判断K+是否存在,若存在,求出其最小浓度,若不存在说明理由:_____________。
按要求填空
(1)硫酸铝(写出电离方程式)
(2)稀硫酸跟氧化镁反应(写出离子方程式)
(3)盐酸跟碳酸氢钠溶液反应(写出离子方程式)
(4)Cu2+ + 2OH—= Cu(OH)2↓(写出化学方程式)
(5)氢氧化铁胶体制备(写出化学方程式)
为建设美丽浙江,浙江省政府开展“五水共治”。
(1)城市饮用水处理时可用二氧化氯(ClO2)替代传统的净水剂Cl2。工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目:_______________。
(2)某地污水中的有机污染物主要成分是三氯乙烯 (C2HCl3),向此污水中加入KMnO4(高锰酸钾的还原产物为MnO2)溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出该反应的化学方程式_________________。
写出下列反应的离子方程式:
(1)Zn粉与稀硫酸溶液的反应:
(2)碳酸钙与稀盐酸溶液的反应:
(3)氢氧化钡溶液与硫酸铜溶液的反应:
铈、钛、锌、锰虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,反应中CeO2作 剂。在加热条件下,CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中NH4Cl的作用是______________ 。
(2)钛(Ti)被誉为“二十一世纪的金属”。
①在高温下,向金红石(主要成分Ti02)与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃性气体。该反应的化学方程式是 。
②加热条件下,镁与TiCl4反应可得到钛,下列气体可以作为保护气的是
A.O2 B.N2 C.C02 D.Ar
(3)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。写出锌和氢氧化钠溶液反应的化学方程式 。
(4)锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料。
①已知A~G各物质间的关系如下图,其中B、D为气态单质。

则反应②的离子方程式为_______________________________________。
②制备Mn02的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为 。已知:Ksp[Al(OH)3]=1×10-33,pH=7.1时Mn(OH)2开始沉淀。室温下,欲除去MnSO4溶液中的Al3+(使其浓度小于1×10-6mol·L-1),需调节溶液pH范围为________。
物质A~E都是由下表中的离子组成的,常温下将各物质的溶液从1 mL稀释到1 000 mL,pH的变化关系如图甲所示,其中A与D反应得到E。
请回答下列问题。
(1)根据pH的变化关系,写出物质的化学式:
B__________,C__________。
(2)写出A与C反应的离子方程式: __________。
工业上为了处理有Cr2O72—的酸性废水,采用下面的处理方法:往工业废水里加入适量的NaCl,以Fe为电极进行电解,经过一段时间后,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中Cr3+的浓度若低于10—5mol/L可符合排放标准。回答下列问题:
(1)电解时阳极上发生的电极反应式: ;
(2)写出Cr2O72—变为Cr3+的离子方程式 ;
(3)工业废水由酸性变为碱性的原因是 ;
(4)已知室温下Cr(OH)3的KSP=1×10—32,则该温度下符合排放标准的溶液的最低pH为 。
下图表示的是用明矾[KAl(SO4)2·12H2O]制取硫酸铝和硫酸钾的操作流程图,请根据此图回答有关问题。

进行操作②时,加入的试剂是 ,从反应混合物中分离A所进行的实验操作是 ,
其反应的离子方程式为 。
按下列要求填空:
(1)写出过氧化氢和过氧化钠的电子式: 、 。
(2)已知叠氮酸(HN3)是与醋酸酸性相近的酸。写出其在水溶液中电离的方程式: 。
(3)已知水溶液中,YO3n-和3S2-发生反应,离子方程式如下:YO3n-+3S2-+6H+=Y-+3S↓+3H2O,则微粒YO3n-所带的电荷为 。
(4)写出钢铁吸氧腐蚀中正极的电极反应式: 。
(5)在标准状况下,1L水中能溶解a L氯化氢气体,所得溶液密度为ρg/cm3 。请计算出氢化氢的物 质的量浓度(要求化简) 。
NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Fe、Cr等杂质)为原料获得。工艺流程如下图:
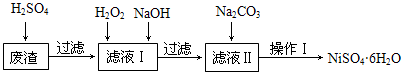
已知:25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表所示。
| |
Fe(OH)2 |
Fe(OH)3 |
Cr(OH)3 |
Ni(OH)2 |
| Ksp |
8.0×10—16 |
4.0×10—38 |
6.0×10—31 |
6.5×10—18 |
| 完全沉淀pH |
≥9.6 |
≥3.2 |
≥5.6 |
≥8.4 |
注:NiCO3是一种不溶于水易溶于强酸的沉淀。
请回答下列问题:
(1)下列措施可行,且能提高废渣浸出率的有 。
A.升高反应温度 B.增大压强 C.在反应过程中不断搅拌
(2)在滤液Ⅰ中加入6%的H2O2,其作用是 (用离子方程式表示);
加入NaOH调节pH的范围是 ,为了除去溶液中的 离子。
(3)滤液Ⅱ的主要成分是 。
(4)检验Ni2+已完全沉淀的实验方法是 。
(5)操作Ⅰ的实验步骤依次为:
① ;
② ;
③蒸发浓缩、冷却结晶,过滤得NiSO4•6H2O晶体;
④用少量乙醇洗涤NiSO4•6H2O晶体并晾干。