按要求填空
(1)硫酸铝(写出电离方程式)
(2)稀硫酸跟氧化镁反应(写出离子方程式)
(3)盐酸跟碳酸氢钠溶液反应(写出离子方程式)
(4)Cu2+ + 2OH—= Cu(OH)2↓(写出化学方程式)
(5)氢氧化铁胶体制备(写出化学方程式)
(9分)“三酸两碱”是重要的化工原料,其中的“两碱”为氢氧化钠和碳酸钠。
(1)氢氧化钠不能保存在带玻璃塞的玻璃瓶中的原因是________________________。
(2)实验室配制100mL 1mol/L氢氧化钠溶液时,下列操作会导致浓度偏低的是_____
a.定容时仰视刻度线
b.容量瓶洗涤后没有干燥就直接用于溶液的配制
c.氢氧化钠溶解后没有冷却至室温,就将溶液转移到容量瓶中
d.定容摇匀后,发现液面低于刻度线,又加水使液面与刻度线相平
(3)将足量二氧化碳通入氢氧化钠溶液中的离子方程式为_________________。
(4)向碳酸钠溶液中逐滴加入稀盐酸至过量,碳酸氢根离子浓度变化趋势是_______;碳酸钠溶液中混有少量碳酸氢钠,可用氢氧化钠来除杂,反应的离子方程式为_______。
现有下列十种物质:① O2 ② Fe ③ CaO ④CO2 ⑤ H2SO4 ⑥ Ba(OH)2 ⑦红褐色的氢氧化铁胶体 ⑧硫酸钠溶液 ⑨稀硝酸 ⑩Cu2(OH)2CO3.
(1)按物质的树状分类法填写表格的空白处:
| 分类标准 |
 |
氧化物 |
|
胶体 |
| 属于该类的物质 |
② |
|
⑧ ⑨ |
|
(2)上述物质属于非电解质的有 ;上述物质能与盐酸反应的电解质有 (填序号)。
(3)上述十种物质中有两种物质之间可发生离子反应:H++OH-= H2O,该离子反应对应的化学反应方程式为__ ________________________________________________________。
(4) 过量的②与⑨发生化学反应的化学方程式为:3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O,该反应的还原剂是 (填化学式),当生成0.05mol的NO气体时,转移的电子的物质的量为__________。
某学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相关问题:
(1)请写出Fe2O3与①反应的离子方程式______________________________。
(2)物质②为_______________。
(3)请写出FeCl3与铁粉反应的化学方程式________________________。
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为_________,此过程中发生的氧化还原反应为(用化学方程式表达)_________________________。
(5)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得分散系③__________________,它与FeCl3溶液、Fe(OH)3浊液的本质区别是_________________________。
按下列要求填空:
(1)写出过氧化氢和过氧化钠的电子式: 、 。
(2)已知叠氮酸(HN3)是与醋酸酸性相近的酸。写出其在水溶液中电离的方程式: 。
(3)已知水溶液中,YO3n-和3S2-发生反应,离子方程式如下:YO3n-+3S2-+6H+=Y-+3S↓+3H2O,则微粒YO3n-所带的电荷为 。
(4)写出钢铁吸氧腐蚀中正极的电极反应式: 。
(5)在标准状况下,1L水中能溶解a L氯化氢气体,所得溶液密度为ρg/cm3 。请计算出氢化氢的物 质的量浓度(要求化简) 。
(1)实验室制取Cl2的反应方程式之一为: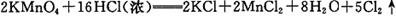 。
。
被氧化的盐酸占反应盐酸总量的 ,用NA表示阿伏加德罗常数的值,当标准状况下有11.2L氯气生成时,该反应的电子转移数为 。
(2)已知下列两个氧化还原反应:O2+4HI 2I2+2H2O 及Na2S+I2══2NaI+S,则三种单质的氧化性顺序由强到弱为:
2I2+2H2O 及Na2S+I2══2NaI+S,则三种单质的氧化性顺序由强到弱为:
(3)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式: ;在以上中性溶液中继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式: 。
(4)医疗上常用小苏打治疗胃酸过多,小苏打溶液与盐酸反应的离子方程式为: 。
下图表示的是用明矾[KAl(SO4)2·12H2O]制取硫酸铝和硫酸钾的操作流程图,请根据此图回答有关问题。

进行操作②时,加入的试剂是 ,从反应混合物中分离A所进行的实验操作是 ,
其反应的离子方程式为 。
炼金废水中含有络离子[Au(CN)2]+,其电离出的CN—有毒,CN-与H+结合生成HCN时,其毒性更强。回答下列问题:
(1)HCN的电离方程式为______________________NaCN溶液的pH_____7(填“< > =”)
(2)与弱电解质的电离方程式相似,[Au(CN)2]+也存在着两步电离,其一级电离方程式为________。
(3)处理这种废水是在碱性条件下,NaClO将CN—氧化为碳酸根和氮气,其离子方程式为:_______。
(4)在酸性条件下,ClO—也能氧化CN--,但实际处理废水时却不在酸性条件下进行的原因是_________。
试样X由氧化亚铁和氧化铜组成,取质量相等的两份试样按图所示进行实验:
(1)请写出步骤③中所发生的全部反应的离子方程式。
(2)若全部的溶液Y和全部的粉末Z充分反应后,生成的不溶物W的质量是m,则每份试样X中氧化铜的质量为______________(用m表示)。
NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Fe、Cr等杂质)为原料获得。工艺流程如下图:
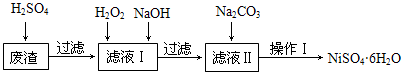
已知:25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表所示。
| |
Fe(OH)2 |
Fe(OH)3 |
Cr(OH)3 |
Ni(OH)2 |
| Ksp |
8.0×10—16 |
4.0×10—38 |
6.0×10—31 |
6.5×10—18 |
| 完全沉淀pH |
≥9.6 |
≥3.2 |
≥5.6 |
≥8.4 |
注:NiCO3是一种不溶于水易溶于强酸的沉淀。
请回答下列问题:
(1)下列措施可行,且能提高废渣浸出率的有 。
A.升高反应温度 B.增大压强 C.在反应过程中不断搅拌
(2)在滤液Ⅰ中加入6%的H2O2,其作用是 (用离子方程式表示);
加入NaOH调节pH的范围是 ,为了除去溶液中的 离子。
(3)滤液Ⅱ的主要成分是 。
(4)检验Ni2+已完全沉淀的实验方法是 。
(5)操作Ⅰ的实验步骤依次为:
① ;
② ;
③蒸发浓缩、冷却结晶,过滤得NiSO4•6H2O晶体;
④用少量乙醇洗涤NiSO4•6H2O晶体并晾干。
写出下列离子方程式:
(1)泡沫灭火器原理:__________________________________________________________________
(2)胃舒平治疗胃酸过多:____________________________________________________________
(3)FeS除去废水中铅离子:_____________________________________________________
完成下列反应的离子方程式:
(1)将AlCl3溶液蒸干得到白色固体: ;
(2)用惰性电极电解饱和食盐水: ;
(3)用KOH做电解质溶液的甲烷燃料电池的负极反应式: ;
(4)往AgCl悬浊液中滴加Na2S溶液: ;
工业上为了处理有Cr2O72—的酸性废水,采用下面的处理方法:往工业废水里加入适量的NaCl,以Fe为电极进行电解,经过一段时间后,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中Cr3+的浓度若低于10—5mol/L可符合排放标准。回答下列问题:
(1)电解时阳极上发生的电极反应式: ;
(2)写出Cr2O72—变为Cr3+的离子方程式 ;
(3)工业废水由酸性变为碱性的原因是 ;
(4)已知室温下Cr(OH)3的KSP=1×10—32,则该温度下符合排放标准的溶液的最低pH为 。
写出下列反应的离子方程式:
(1)Zn粉与稀硫酸溶液的反应:
(2)碳酸钙与稀盐酸溶液的反应:
(3)氢氧化钡溶液与硫酸铜溶液的反应:
元素周期表中第三周期元素的单质及其化合物的用途广泛。
(1)该周期元素中,半径最小的简单离子的离子结构示意图为 。
(2)能证明氯的非金属性(得电子能力)比硫强的化学方程式为 。
(3)NaHSO3溶液呈酸性,其溶液中离子浓度由大到小的顺序为 。
(4)ClO2可将弱酸性废水中的Mn2+转化为MnO2而除去,同时ClO2被还原为Cl—,该反应的离子方程式为 。
(5)已知下列两反应过程中能量变化如图所示:
汽车尾气中含有的少量NO2和SO2在一定条件下会发生反应,该反应的热化学方程式为____________。