江西省吉安市高一上学期期末考试化学试卷
现在频频出现的大雾天气,致使高速公路关闭,航班停飞。雾中小水滴直径范围是
| A.小于0.1nm | B.大于100nm |
| C.在1nm—100nm间 | D.小于1nm |
为了除去FeCl3溶液中混有的少量FeCl2,其方法是向此溶液中
| A.加入Fe | B.加入Cu | C.滴加氯水 | D.滴加稀硝酸 |
下列操作中,溶液的颜色不发生变化的是
| A.氧化镁固体加入稀盐酸中,完全溶解 |
| B.氢氧化铜加入到稀硫酸中 |
| C.氯化铁溶液中加入足量铜粉,充分振荡 |
| D.氯化铁溶液中滴加硫氰化钾(KSCN)溶液 |
下列储存药品的方法中,正确的是
| A.浓硝酸保存在橡胶塞试剂瓶中 | B.硝酸银溶液保存在无色试剂瓶中 |
| C.铝片密封保存在细口瓶中 | D.金属钠保存在煤油中 |
用NA表示阿伏加德罗常数,下列叙述正确的是
| A.常温常压下,1.42g Na2SO4含有的Na+离子数为0.02NA |
| B.标准状况下,22.4LCCl4含有的分子数为NA |
| C.常温常压下,NA个Ar分子占有的体积为22.4L |
| D.物质的量浓度为2mol/L的MgCl2溶液中,含有Cl-个数为4NA |
下列有关实验操作说法正确的是
| A.用分液漏斗分离汽油和植物油 |
| B.向试管中滴加液体时,胶头滴管紧贴试管内壁 |
| C.加热试管内物质时,试管底部与酒精灯灯芯接触 |
| D.过滤时,漏斗下端紧贴烧杯内壁 |
HO2(超氧酸)是一种弱酸,具有极高的活性。一定条件下,铜与盐酸、氧气发生如下反应可生成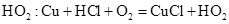 ,下列说法正确的是
,下列说法正确的是
| A.上述反应中,O2发生了氧化反应 |
| B.HO2在碱溶液中能稳定存在 |
| C.上述反应中HO2是还原产物 |
D.上述反应的离子方程式为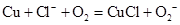 |
氧气与甲烷的混合气体中,若氧气与甲烷的质量比为4:1(极易爆炸),则其体积比为
| A.2:1 | B.1:1 | C.1:4 | D.1:2 |
下列离子方程式书写正确的是
A.铜和醋酸: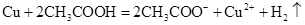 |
B.氧化铁与稀盐酸: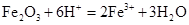 |
C.铜和硝酸银溶液: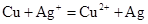 |
D.稀硝酸和石灰乳: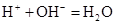 |
下列各组物质,按混合物、单质、化合物顺序排列正确的是
| A.空气、臭氧、胆矾 | B.碘酒、白磷、盐酸 |
| C.干冰、氮气、冰 | D.生石灰、液氧、大理石 |
赏心悦目的雕花玻璃是用下列物质中的一种对玻璃进行刻蚀而制成的,这种物质是
| A.纯碱 | B.氢氟酸 | C.氢碘酸 | D.火碱 |
下列说法中错误的是
| A.燃烧一定是氧化还原反应 | B.燃烧一定会放出热量 |
| C.燃烧一定有氧气参加 | D.燃烧一定伴有发光现象 |
双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式为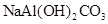 。关于该物质的说法正确的是
。关于该物质的说法正确的是
| A.该物质属于两性氢氧化物 |
B.该物质是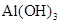 和 和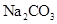 的混合物 的混合物 |
C.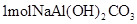 ,最多可消耗4mol ,最多可消耗4mol 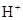 |
| D.该药剂不适合于胃酸过多的胃病患者 |
某探究小组在如下实验方案设计中,用铝片、铜片、铁片三种金属和氢氧化钠溶液、稀硝酸、浓硫酸、浓盐酸四种溶液进行实验。请根据要求填空:
(1)若欲证明上述三种金属的活动性强弱,则有关反应的化学方程式为____________。
(2)室温下,将三种金属分别投入上述某种溶液中,均不能观察到明显的现象,这种溶液是___________。
(3)上述某一溶液只能和三种金属中的一种发生化学反应,其离子方程式为_______________________。
(4)室温下,上述某一溶液能和三种金属发生反应,该溶液是_____________。
(5)可用于除去氧化铜粉末中混有的少量氧化铝粉,该溶液是_____________。
由A元素组成的一种单质是重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料,C与烧碱反应生成含A元素的化合物D。
(1)列举化合物D的两种用途:_____________。
(2)下列物质的主要成分为C的有_____________(填字母)。
a.沙子 b.水玻璃 c.黏土 d.玛瑙
(3)将C与纯碱混合,高温熔融时也能发生反应生成D,同时还生成B元素的最高价氧化物E;将E通入足量D的水溶液中,又发生反应生成含A元素的化合物F。
①C与纯碱混合高温熔融时发生反应的化学方程式为__________________________。
②E与足量D的水溶液反应的离子方程式为_____________。
金属铝在酸性或碱性溶液中均可与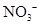 发生氧化还原反应,转化关系如图所示:
发生氧化还原反应,转化关系如图所示: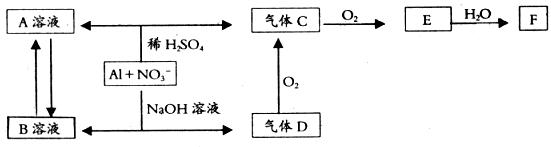
请回答下列问题:
(1)气体D和F反应可生成盐,该盐的化学名称为 _____________。
(2)C、E排入大气中会造成大气污染,在催化剂存在的情况下,D可以将C、E还原为无毒的气态单质,该单质是_____________(填化学式)。
(3)将B转化为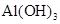 的最佳试剂是_____________(填字母)。
的最佳试剂是_____________(填字母)。
a.CO2 b.NaOH c.HCl d.NH3·H2O
(4)写出D→C反应的化学方程式:__________________________。
(5)Al与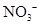 在酸性条件下反应的离子方程式为:__________________________。
在酸性条件下反应的离子方程式为:__________________________。
(6)Al与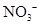 在碱性条件下反应,Al与被还原的
在碱性条件下反应,Al与被还原的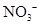 的物质的量之比为_____________。
的物质的量之比为_____________。
科学探究结果的准确性有赖于探究方法的科学性。某课外活动小组用下图装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨反应的装置。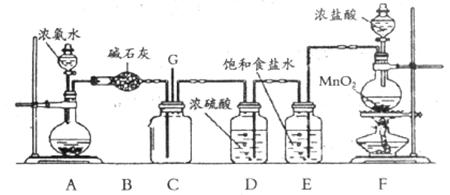
请回答下列问题:
(1)装置F中发生反应的化学方程式为_____________;浓盐酸在该反应中所表现出的性质为_____________、_____________。
(2)装置E的作用是:__________________________。
(3)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。写出反应的化学方程式__________________________。
(4)该活动小组中甲、乙两位同学按下图装置继续进行实验: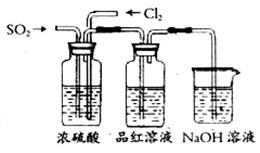
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是:__________________________,其有关反应的离子方程式为__________________________。
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?_______________________。
已知NaOH与NaHCO3发生反应的方程式为:
Ⅰ.实验室用氢氧化钠固体配制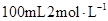 的NaOH溶液,回答下列问题:
的NaOH溶液,回答下列问题:
(1)下列操作的顺序是(每项限选一次)_____________。
| A.称量 |
| B.溶解 |
| C.洗涤 |
| D.定容 |
E.转移
F.摇匀
G.冷却
(2)若容量瓶中有少量蒸馏水,所配溶液的浓度将_____________;(填“偏大”、“偏小”或“无影响”)
(3)在定容操作时,俯视容量瓶刻度线,则所配溶液的浓度将_____________(填“偏大”、“偏小”或“无影响”)。
Ⅱ.在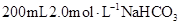 溶液中加入一定量的常见纯净物X,恰好使其转化为只含Na2CO3溶质的溶液,实现转变的物质X有多种,请回答下列问题:
溶液中加入一定量的常见纯净物X,恰好使其转化为只含Na2CO3溶质的溶液,实现转变的物质X有多种,请回答下列问题:
(1)请填写下表空白。
| 编号 |
① |
② |
③ |
④ |
| X的化学式 |
|
NaOH |
Na2O2 |
|
| 加入X的质量(g) |
9.2 |
|
15.6 |
|
(2)反应后,溶液中的Na+的物质的量均为_____________mol。
(3)在①~④中,所得Na2CO3溶质的质量分数相等的是_____________(填编号)。
 、
、 、
、 、
、
 、
、 、
、 、
、
 、
、 、
、
 、
、 、
、
 粤公网安备 44130202000953号
粤公网安备 44130202000953号