下列解释实验事实的化学方程式或离子方程式正确的是
A.用pH试纸检测,氨水溶液呈碱性: NH3·H2O  NH4+ + OH— NH4+ + OH— |
B.100℃时,测得纯水中c(H+)·c(OH—) =1×10—12:H2O(l)  H+(aq) + OH—(aq) H+(aq) + OH—(aq) H<0 H<0 |
C.FeCl3溶液中通入适量SO2,溶液黄色褪去:2Fe3++SO2 +2H2O  2Fe2+ + SO42—+ 4H+ 2Fe2+ + SO42—+ 4H+ |
| D.向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5ONa+CO2+H2O →2C6H5OH+Na2CO3 |
下列指定反应的离子方程式正确的是
| A.用白醋除铁锈:Fe2O3·xH2O + 6H+= (3+x)H2O + 2Fe3+ |
| B.用强碱溶液吸收工业制取硝酸尾气: NO + NO2 + 2OH-= 2NO3- + H2O |
| C.将少量SO2气体通入氨水中:SO2 + NH3·H2O=NH4++ HSO3- |
| D.向稀硫酸中加入少量Ba(OH)2溶液:2H++ SO42-+ Ba2++ 2OH-= BaSO4↓ + 2H2O |
下列关于离子反应及离子共存的说法中正确的是
| A.能使甲基橙显红色的溶液中,Ba2+、Fe2+、Cl-、NO3-可以大量共存 |
| B.钢铁发生吸氧腐蚀的正极反应:O2+4e-+4H+=2H2O |
| C.常温下,由水电离的c(H+)=10-12mol/L的溶液:K+、Na+、SiO32-、HCO3-可以大量共存 |
| D.NaHCO3溶液中滴入少量Ca(OH)2溶液:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O |
稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
| A.电解熔融CeO2制Ce,铈在阳极获得。 |
| B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+ |
C.铈溶于氢碘酸的化学方程式为:Ce +4HI CeI4+2H2↑ CeI4+2H2↑ |
D.四种稳定的核素 Ce、 Ce、 Ce、 Ce、 Ce、 Ce、 Ce它们互称为同素异形体 Ce它们互称为同素异形体 |
下列叙述正确的是
| A.NaHCO3与石灰水反应,当n(NaHCO3):n[Ca(OH)2]=1:1时,HCO3-部分转化为CaCO3 |
| B.CO2通入石灰水中,当n(CO2):n[Ca(OH)2]=1:1时,能得到澄清溶液 |
C.AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=1:1时,铝元素以 形式存在 形式存在 |
| D.Fe与稀硝酸反应,当n(Fe):n(HNO3) =1:1时,溶液中铁元素以Fe2+形式存在 |
稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易被氧化变暗,且受热易燃烧,遇水很快反应。下列说法正确的是(已知:铈常见的化合价有+3和+4,氧化性:Ce4+>Fe3+)
| A.电解熔融CeO2制Ce时,铈在阳极获得 |
| B.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑ |
| C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+ |
D.Ce有四种稳定的核素嚣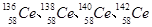 ,它们互称为同位素 ,它们互称为同位素 |
下列有关离子的各种说法中,正确的是
| A.金属钠溶于足量水中的离子方程式:Na+2H2O=Na++H2↑+2OH- |
| B.加入铝粉后产生大量氢气的溶液中:NH4+、Na+、NO3-、Cl-可以大量共存 |
| C.等物质的量浓度、等体积的氨水与盐酸混和,溶液中离子浓度关系为:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D.等物质的量的二元弱酸H2X与其钾盐K2X的混合溶液中 c(K+)=c(H2X)+c(HX-)+c(X2-) |
金属铈(稀土元素)性质活泼。铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2。下列说法正确的是
| A.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI ="=" CeI4 + 2H2↑ |
| B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + Fe2+ = Ce3+ + Fe3+ |
| C.在一定条件下,电解熔融状态的CeO2制Ce,在阳极获得铈 |
D.四种铈的核素 Ce、 Ce、 Ce、 Ce、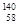 Ce、 Ce、 Ce,它们互称为同素异形体 Ce,它们互称为同素异形体 |
11.下列热化学方程式或离子方程式中,正确的是
| A.0.01mol·L-1NH4Al(SO4)2溶液与0.02mol·L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O |
B.一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 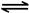 2NH3(g) △H=-38.6kJ·mol-1 2NH3(g) △H=-38.6kJ·mol-1 |
| C.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+==AgBr↓ |
| D.CO(g)的燃烧热是283.0 kJ·mol-1,则CO2分解的热化学方程式为:2CO2(g) =2CO(g)+O2(g)ΔH=+283.0 kJ·mol-1 |
下列离子方程式或化学方程式与所述事实相符且正确的是
A.硫酸与氢氧化钡反应的中和热化学反应方程式为: H2SO4(aq)+ H2SO4(aq)+ Ba(OH)2(aq)= Ba(OH)2(aq)= BaSO4(s)+H2O(l) ΔH=-57.3 kJ/mol BaSO4(s)+H2O(l) ΔH=-57.3 kJ/mol |
| B.向0.1 mol·L-1、pH=1的NaHA溶液中加入NaOH溶液:H++OH-=H2O |
C.以金属银为阳极电解饱和硫酸铜溶液:2Cu2++2H2O 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ |
| D.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
下列说法中正确的是
| A.常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存 |
| B.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳:ClO-+CO2+ H2O =HClO+HCO3- |
| C.一定温度下,1L0.5mol·L-1NH4Cl溶液中与2L0.25mol·L-1NH4Cl溶液含NH4+物质的量相同 |
| D.常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、SO42-、NH4+可能大量共存 |
下列离子方程式不正确的是
A.用稀硫酸除去铜绿:4H++Cu2(OH)2CO3 2Cu2++CO2↑+3H2O 2Cu2++CO2↑+3H2O |
B.将Na2O2固体投入H218O中:2H218O+2Na2O2 4OH-+4Na++18O2↑ 4OH-+4Na++18O2↑ |
C.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42—完全沉淀:2Ba2++NH4++Al3++2SO42—+4OH- Al(OH)3+NH3·H2O+2BaSO4 Al(OH)3+NH3·H2O+2BaSO4 |
D.向Na2FeO4溶液中加入稀硫酸产生氧气:4 FeO42—+20H+ 4Fe3++3O2↑+10H2O 4Fe3++3O2↑+10H2O |
下列对应化学反应的离子方程式正确的是
A.KIO3与KI在酸性溶液中反应: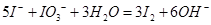 |
B.向碳酸氢铵溶液中加过量氢氧化钠溶液并加热: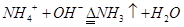 |
C.将过量二氧化硫通入稀氨水中: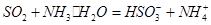 |
D.用稀硝酸洗涤试管内壁的银镜: |