现有A、B、C、D、E五种常见短周期元素,已知:
①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;
②A、D同主族,A是所有元素中原子半径最小的元素;B与C的位置相邻;C元素原子最外层电子数是次外层电子数的3倍;
③B、D、E三者的最高价氧化物有水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;
④B、E两种元素原子最外层电子数之和等于A、C、D三种元素原子最外层电子数之和。
请填写下列空白:
(1)写出乙+丙在溶液中反应的离子方程式_________________________________________。
(2)化合物BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为:___________________________________________。
(3)某原电池中,电解质溶液为稀H2SO4,分别向负极通入碳元素与元素C(原子物质的量之比1:1)形成的化合物,向正极通入元素C最常见的单质,试完成下列问题:
正极反应:________________________;
负极反应:________________________;
电解质溶液pH的变化_______.(填“增大”“减小”或“不变”.下同)
(14分)A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化关系如图所示(部分产物已略去)。

请按要求回答下列问题:
(1)若B、D为短周期同一主族的非金属单质,则反应(III)中氧化产物与还原产物的物质的量之比为___。
(2)若A、B、C均为短周期元素组成的化合物,且溶液都显碱性,D为植物光合作用必须吸收的气体,物质A中化学键的类型为________________,相同温度下的溶解度B___________C(填“大于、小于、等于”)。
(3)若D为某金属单质,向C的溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则检验B溶液中阳离子的试剂为_________;C的溶液保存时,常加入D的目的是__________________。
(4)若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,写出反应(III)的离子方程式是_______________________________;符合条件的D物质可能是_______________(填序号)。
①硫酸 ②碳酸 ③氢氧化钠 ④一水合氨 ⑤氯化钡
【原创】C、N、O、Na、Al、Si、Cl、Fe是常见的元素
(1)Fe元素位于元素周期表的位置 ;二氧化碳的结构式为 。
(2)以上某种元素的氢化物和该元素的最高价含氧酸反应可以生成盐,请写出实验室制备该元素氢化物的化学方程式:____________________________________________。
(3)碳和硅的最高价氧化物对应水合物的酸性强弱顺序为:__________________。
(4)以上主族元素中金属性最强的是__________。单质能用于芯片的是____________。(写元素符号)
(5)氧化铝和氢氧化钠反应的离子方程式为:________________________。
【改编】部分中学化学常见元素原子结构及性质如表所示:
| 序号 |
元素 |
结构及性质 |
| ① |
A |
A单质是中学化学常见金属,在空气中燃烧生成淡黄色固体 |
| ② |
B |
B与A在同一周期,电子层数等于最外层电子数 |
| ③ |
C |
C是常见化肥的主要元素,单质常温下呈气态 |
| ④ |
D |
D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| ⑤ |
E |
通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 |
| ⑥ |
F |
F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
(1)A原子在周期表中的位置为________。
(2)B与E形成的化合物的化学式为______,它属于_____化合物(填“酸性”或“碱性”或“两性”)。
(3)F与E可以形成10电子和18电子的两种化合物X和Y,区别X与Y的水溶液的实验方法是__________________________________________________________。
(4)C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱____________。
(5)A和B的最高价氧化物对应的水化物之间反应的离子方程式为:_________________________。
【原创】针对下面9种元素,完成以下各小题
(1)单质为有色气体的元素是___________(填名称)。
| 周期 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
O |
| 2 |
|
|
|
① |
② |
③ |
|
|
| 3 |
④ |
⑤ |
⑥ |
⑦ |
|
⑧ |
⑨ |
|
(2)③与④⑤简单离子的半径由大到小的顺序为___________(填元素符号)。
(3)元素②的单质的电子式为__________。
(4)最高价氧化物对应的水化物酸性最强的是___________________。(填化学式)
(5)④和⑥的最高价氧化物对应的水化物反应的离子方程式为___________。
(6)⑦的单质的用途正确的是___________。
A.光导纤维 B.太阳能电池 C.普通玻璃 D.计算机芯片
(7)元素①和⑦非金属性较强的是____,写出一个能表示二者非金属性强弱关系的化学方程式为:__________。
现有A、B、C、D、E五种常见短周期元素,已知:
①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;
②A、D同主族,A是所有元素中原子半径最小的元素;B与C的位置相邻;C元素原子最外层电子数是次外层电子数的3倍;
③B、D、E三者的最高价氧化物有水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;
④B、E两种元素原子最外层电子数之和等于A、C、D三种元素原子最外层电子数之和。
请填写下列空白:
(1)写出乙+丙在溶液中反应的离子方程式_________________________________________。
(2)化合物BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为:___________________________________________。
(3)某原电池中,电解质溶液为稀H2SO4,分别向负极通入碳元素与元素C(原子物质的量之比1:1)形成的化合物,向正极通入元素C最常见的单质,试完成下列问题:
正极反应:________________________;
负极反应:________________________;
电解质溶液pH的变化_______.(填“增大”“减小”或“不变”.下同)
【改编】Ⅰ.M、A、B、C、D、E均为短周期主族元素,A的最外层电子数是M的4倍,A、B、C、D、E、F在周期表中位置如图所示。(请用化学用语作答)
| A |
B |
C |
D |
| |
|
E |
F |
(1)A在周期表中的位置 。
(2)D、E、F三种元素形成的简单离子半径由大到小的顺序为 。
(3)由M、B、C三种元素以原子个数比4:2:3形成化合物Q,Q中所含化学键类型有 。检验该化合物中阳离子的方法是 。(用离子方程式表示)。
(4)B与C可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有 。
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
Ⅱ.一定条件下,2X(g)+Y(g) 2Z(g)+W(s)。
2Z(g)+W(s)。
(5)若反应在一定温度的恒容条件下进行,按下表数据投料,反应达到平衡状态,数据如下:
| 物质 |
X |
Y |
Z |
W |
| 起始投料/ mol |
2 |
1 |
2 |
0 |
| 平衡时物质的量 |
|
0.2 |
|
|
则平衡时容器的压强与原来压强的比值为________,X的转化率为__________。
锌是一种常用金属,冶炼方法有火法和湿法。
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。氮化镓(GaN)是制造LED的重要材料,被誉为第三代半导体材料。
(1)Ga的原子结构示意图为____________________。
(2)GaN可由Ga和NH3在高温条件下合成,该反应的化学方程式为_____________________。
(3)下列有关镓和镓的化合物的说法正确的是____________________(填字母序号)。
| A.一定条件下,Ga可溶于盐酸和氢氧化钠 |
| B.常温下,Ga可与水剧烈反应放出氢气 |
| C.Ga2O3可由Ga(OH)3受热分解得到 |
| D.一定条件下,Ga2O3可与NaOH反应生成盐 |
II.工业上利用锌焙砂(主要含Zn0、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示,回答下列问题:
已知:Fe的活泼性强于Ni
(4)ZnFe2O4可以写成ZnO·Fe2O3,写出ZnFe2O4与H2SO4反应的化学方程式________________。
(5)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,只使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是_____________________________________________________。
(6)净化II中加入Zn的目的是______________________________________________。
(7)常温下,净化I中,如果要使c(Fe3+) < 10-5 mol/L,则应控制溶液pH的范围为_______________。
已知:Ksp[Fe(OH)3] =" 8.0" × 10-38;lg5 = 0.7
【化学-选修3物质结构与性质】(15分)早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________方法区别晶体、准晶体和非晶体。
(2)基态Fe原子有_______个未成对电子,Fe3+的电子排布式为_________。可用硫氰化钾检验Fe3+,形成的配合物的颜色为____________。
(3)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道为___________,1mol乙醛分子中含有的 键的数目为___________。乙酸的沸点明显高于乙醛,其主要原因是___________ 。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和定点,则该晶胞中有 个铜原子。
键的数目为___________。乙酸的沸点明显高于乙醛,其主要原因是___________ 。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和定点,则该晶胞中有 个铜原子。
(4)Al单质为面心立方晶体,其晶胞参数 nm,晶胞中铝原子的配位数为 。列式表示Al单质的密度 g
nm,晶胞中铝原子的配位数为 。列式表示Al单质的密度 g cm-3。
cm-3。
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:① Z的原子序数为29,而Q、R、X、Y均为短周期主族元素;② R原子有3个未成对电子;③ Q、X原子p轨道的电子数分别为2和4;④ Y原子价电子(外围电子)排布为msnmpn。请回答下列问题:
(1)R的氢化物RH3中R采取______杂化,其键角_____109°28′(选填“>”、“=”或者“<”)。
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是(选填字母代号)_____。
a.稳定性:甲>乙;沸点:甲>乙
b.稳定性:甲>乙;沸点:甲<乙
c.稳定性:甲<乙;沸点:甲<乙
d.稳定性:甲<乙;沸点:甲>乙
(3)下列与H2X分子互为等电子体的微粒有(选填字母代号) 。
a.CH4 b.H2S c.NO2 d.NH2-
(4)由X和Y形成的化合物属于________晶体(填晶体类型),30 g该晶体中有_____mol共价键。
(5)Z是 (填元素符号),它位于周期表的 区,其晶体的三维堆积模型见下图,
称之为面心立方最密堆积,其配位数为 。Z2+的外围电子排布式是____________。1个Z2+与4个RH3以配位键结合形成_________________离子(填化学式)。
【化学——选修3:物质结构与性质】
目前半导体生产展开了一场“铜芯片”革命——在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下: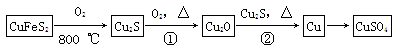
(1)基态铜原子的外围电子层排布为__________________,硫、氧元素相比,第一电离能较大的元素是________(填元素符号)。
(2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是________,其立体结构是______________。
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液 蓝色沉淀
蓝色沉淀 沉淀溶解,得到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式_______________________;深蓝色透明溶液中的阳离子内存在的化学键类型有 。
沉淀溶解,得到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式_______________________;深蓝色透明溶液中的阳离子内存在的化学键类型有 。
(4)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途,铜晶体中铜原子堆积模型为_____________;铜的某种氧化物晶胞结构如图所示,若该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞中铜原子与氧原子之间的距离为________cm。((用含d和NA的式子表示)。
【化学——选修3物质结构与性质】原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为 。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是 (填化学式),呈现如此递变规律的原因是 。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 ,另一种的晶胞如图二所示,该晶胞的空间利用率为 (保留两位有效数字)。(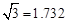 )
)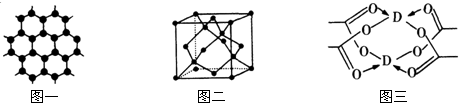
(4)D元素形成的单质,其晶体的堆积模型为 ,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是 (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是 。请写出上述过程的离子方程式 。
【化学——选修3:物质结构与性质】
A、B、C、D、E是元素周期表中五种短周期元素,原子序数依次增大。A、B、C、D位于同一周期。已知A原子核外有3个能级,且每个能级上的容纳的电子数目相同。C与E同主族,且C的单质为空气中的主要成份。X元素的原子核外有26个运动状态完全不相同的电子。回答下列问题:
(1)C、D、E中第一电离能最大的是 (填元素符号),X的价电子排布式为 。
(2)B的气态氢化物分子呈 形。该分子的中心原子的杂化方式为 。
(3)A的一种单质相对分子质量为720,分子构型为一个32面体,其中有12个五元环,20个六元环(如图1)。则1molA的这种单质中π键的数目为 。
(4)X元素对应的单质在形成晶体时,采用如图2所示的堆积方式。
则这种堆积模型的配位数为 ,如果X的原子半径为a cm,阿伏加德常数的值为NA,则计算此单质的密度表达式为 g/cm3(不必化简)。
(A)【化学—物质结构与性质】
物质中铁含量的测定方法是多种多样的。
I.土壤中铁含量的测定是先将Fe3+还原为Fe2+,然后使Fe3+与邻啡罗啉 结合显橙红色,再用比色法测定。其中涉及以下反应:4FeCl3 + 2NH2OH·HCl=4FeCl2 + N2O↑+ 6HCI + H2O。
结合显橙红色,再用比色法测定。其中涉及以下反应:4FeCl3 + 2NH2OH·HCl=4FeCl2 + N2O↑+ 6HCI + H2O。
(1)基态Fe2+的核外电子排布式为 。
(2)羟胺(NH2OH)中采用sp3杂化的原子是 ;羟胺极易溶于水,主要原因是 。
(3)羟胺的组成各元素中,元素的第一电离能(I1)由大到小的顺序为 (用元素符号表示)。
(4)吡啶 和邻啡罗啉都是含氮的有机物,l mol吡啶中含有σ键的物质的量为 mol。
和邻啡罗啉都是含氮的有机物,l mol吡啶中含有σ键的物质的量为 mol。
Ⅱ.奶粉中铁含量的测定是在酸性介质中使Fe3+与K4Fe(CN)6生成普鲁士蓝(Ⅱ)(化学式为Fe4[Fe(CN)6]3),再用光度法测定铁的含量。反应原理如下:
3K4Fe(CN)6+4FeCl3=Fe4[Fe(CN)6]3↓+12KCl
(5)Fe4[Fe(CN)6]3是一种配合物,其中含有的化学键有_______;
a.共价键
b.氢键
c.配位键
d.金属键
e.离子键
(6)若K4 Fe(CN)6和FeCl3的物质的量按某种比例发生反应,可生成普鲁士蓝(I),其晶胞结构如下图所示:据此判断普鲁士蓝(I)中n(K+):n(Fe3+):n (Fe2+):n (CN—)= 。
Ⅰ.A、B、C、D、E为五种常见的短周期元素,常温下,A、B可形成B2A2和B2A两种液态化合物,B与D可组成分子X,X水溶液呈碱性,C元素的焰色反应呈黄色,E与C同周期,且E的最高价氧化物的水化物呈两性。试回答:
(1)D元素在周期表中的位置为 ;
(2)由A、D、E三种元素形成的盐的水溶液呈酸性,用离子方程式解释其原因 ;
(3)用A单质和B单质可制取气体燃料电池,该电池用多孔的惰性电极浸入浓KOH溶液,两极分别通入A单质和B单质。写出该电池负极的电极反应式: 。
Ⅱ.将20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1mol·L-1Na2CO3溶液中,向此反应后的溶液中滴加0.001 mol·L-1BaCl2溶液,首先析出的沉淀是 。[KSP(BaSO4)=1.1×10-10mol2·L-2;KSP(BaCO3)=5.1×10-9mol2·L-2]
Ⅲ.某温度下在容积固定的密闭容器中,下列反应达到平衡:M(g)+H2O(g) N(g)+H2(g)
N(g)+H2(g)
| n(M):n(H2O) |
M转化率 |
H2O转化率 |
| 1:1 |
0.5 |
0.5 |
| 1:2 |
0.67 |
0.33 |
| 1:3 |
0.75 |
0.25 |
①该反应的平衡常数为_____。该温度下,向容器中充入1molM、3mol H2O、2mol N、1.5molH2,则起始时该反应速率V正____V逆(填“>”、“<”或“=”)
②结合表中数据判断下列说法中正确的是 。
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的之比为1:4时,M的转化率为0.85