湖北省仙桃天门潜江高三上学期期末联考理综化学试卷
下列说法正确的是
| A.燃料电池由外设装备提供燃料和氧化剂 |
| B.Mg和Al通常用热还原的方法来冶炼 |
| C.绿色化学的核心是应用化学原理对环境污染进行治理 |
| D.蛋白质、棉花、淀粉、油脂都是由高分子组成的物质 |
关于某有机物 的性质叙述正确的是
的性质叙述正确的是
| A.1 mol该有机物可以与3 mol Na发生反应 |
| B.1 mol该有机物可以与3 mol NaOH发生反应 |
| C.1 mol该有机物可以与6 mol H2发生加成反应 |
| D.1 mol该有机物分别与足量Na或NaHCO3反应,产生的气体在相同条件下体积相等 |
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中正确的是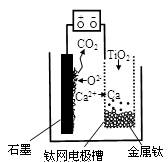
| A.将熔融CaF2—CaO换成Ca(NO3)2溶液也可以达到相同目的 |
| B.阳极的电极反应式为:C+2O2--4e-=CO2↑ |
| C.在制备金属钛前后,整套装置中CaO的总量减少 |
| D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极 |
下列说法正确的是
| A.水的离子积KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度 |
| B.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关 |
| C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4C1晶体,能使溶液的pH减小,c(NH4+)/c(NH3·H2O)的比值增大 |
D.室温下,CH3COOH的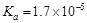 ,NH3·H2O的 ,NH3·H2O的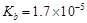 ,CH3COOH溶液中的c (H+)与NH3·H2O中的c(OH-)相等 ,CH3COOH溶液中的c (H+)与NH3·H2O中的c(OH-)相等 |
下列实验操作、现象与结论对应关系正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
向盛有Fe(NO3)2溶液的试管 中加入0.1mol/L H2SO4溶液 |
试管口出现红棕色 气体 |
溶液中NO3—被 Fe2+还原为NO2 |
| B |
向饱和Na2CO3溶液中通入足 量CO2 |
溶液变浑浊 |
析出Na2CO3晶体 |
| C |
等体积pH=2的HX和HY两 种酸分别与足量的铁反应,排 水法收集气体 |
HX放出的氢气多且 反应速率快 |
HX酸性比HY弱 |
| D |
先向2mL0.1mol/LNa2S溶液中 滴几滴0.1mol/LZnSO4溶液,再 加入几滴0.1mol/LCuSO4溶液 |
开始有白色沉淀生成;后又有黑色沉淀生成 |
Ksp(ZnS)<Ksp(CuS) |
某温度下,向2 L恒容密闭容器中充入1.0 mol A和1.0 mol B,反应A(g)+B(g)  C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是
C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是
| t/s |
0 |
5 |
15 |
25 |
35 |
| m (A)/mol |
1.0 |
0.85 |
0.81 |
0.80 |
0.80 |
A.反应在前5 s的平均速率v(A)=0.17mol∙L-1∙s-1
B.保持其他条件不变,升高温度,平衡时c(A)=0.41mol∙L-1,则反应的ΔH>0
C.相同温度下,起始时向容器中充入2.0 mol C达到平衡时,C的转化率大于80%
D.相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前V(正)<V(逆)
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构,下列说法一定正确的是:
| A.原子最外层电子数: Z>Y>X | B.单质沸点:X>Y>Z |
| C.离子半径:X2->Z->Y+ | D.原子序数:X>Z>Y |
某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1mol/L(此数值忽略水的电离及离子的水解)。
| 阳离子 |
K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
| 阴离子 |
Cl- CO32- NO3- SO42- SiO32- I- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ、取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ、用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ、另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ、向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是 。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是 。
(3)甲同学最终确定原溶液中所含阳离子有 ,阴离子有 ;并据此推测原溶液应该呈 性,原因是 (请用离子方程式说明)。
(4)在100mlHNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6mol/L。向该溶液中加入足量的铜粉,加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大(反应前后溶液体积变化忽略不计),则H2SO4和HNO3两种酸的物质的量浓度之比为 。
(14分)4,7—二甲基香豆素(熔点:132.6℃)是一种重要的香料,广泛分布于植物界中,由间—甲苯酚为原料的合成反应如下: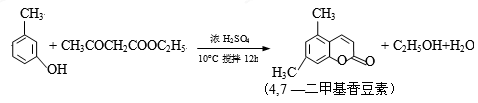
实验装置图如下:
主要实验步骤:
步骤1.向装置a中加入60mL浓硫酸,并冷却至0℃以下,搅拌下滴入间—甲苯酚30mL(0.29mol)和乙酰乙酸乙酯26.4mL (0.21mol)的混合物。
步骤2.保持在10℃下,搅拌12h,反应完全后,将其倒入冰水混合物中,然后抽滤、水洗得粗产品
步骤3.粗产品用乙醇溶解并重结晶,得白色针状晶体并烘干,称得产品质量为33.0g。
(1)图中仪器名称:a 。
(2)简述装置b中将活塞上下部分连通的目的 。
(3)浓H2SO4需要冷却至0℃以下的原因是 。
(4)反应需要搅拌12h,其原因是 。
(5)本次实验产率为 。
(6)实验室制备乙酸乙酯的化学反应方程式 ,用 (填药品名称)收集粗产品,用 (填操作名称)的方法把粗产品分离。
(15分)(一)尿素又称碳酰胺,是含氮量最高的氮肥,工业上利用二氧化碳和氨气在一定条件下合成尿素。其反应分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l) △H1=" -330.0" kJ·mol-1
H2NCOONH4(氨基甲酸铵) (l) △H1=" -330.0" kJ·mol-1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2=" +" 226.3 kJ·mol-1
H2O(l)+H2NCONH2(l) △H2=" +" 226.3 kJ·mol-1
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 m3 密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:
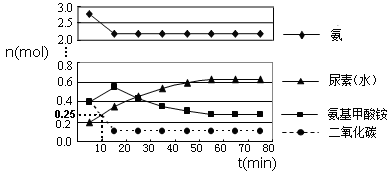
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定。
②反应进行到10 min时测得CO2的物质的量如上图所示,则用CO2表示的第一步反应的速率v(CO2)= mol/(L·min)。
③当反应在一定条件下达到平衡,若在恒温、恒容下再充入一定量气体He,则CO(NH2)2(l)的质量_______(填“增加”、“减小”或“不变”)。
(二)氨是制备尿素的原料,氨气溶于水得到氨水,在25℃下,将a mol/L的氨水与b mol/L的硫酸以3∶2体积比混合反应后溶液呈中性。用含a和b的代数式表示出氨水的电离平衡常数为_________。此溶液中各离子浓度由大到小的顺序为_________。
(三)氢气是合成氨的原料。“氢能”将是未来最理想的新能源。
(1)在25℃,101KPa条件下,1 g氢气完全燃烧生成液态水时放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为 。
(2)氢气通常用生产水煤气的方法制得。其中C(s)+ H2O(g)  CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。
CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。
①当加热到850℃反应达到平衡的标志有______________ 。
| A.容器内的压强不变 |
| B.消耗水蒸气的物质的量与生成CO的物质的量相等 |
| C.混合气的密度不变 |
| D.单位时间有n个H—O键断裂的同时有n个H—H键断裂 |
②x应满足的条件是 。
【化学——选修3物质结构与性质】原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为 。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是 (填化学式),呈现如此递变规律的原因是 。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 ,另一种的晶胞如图二所示,该晶胞的空间利用率为 (保留两位有效数字)。(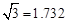 )
)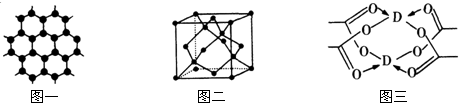
(4)D元素形成的单质,其晶体的堆积模型为 ,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是 (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是 。请写出上述过程的离子方程式 。
【化学——选修5有机化学基础】
G是一种合成橡胶和树脂的重要原料,A是C、H、O三种元素组成的五元环状化合物,相对分子质量为98,其核磁共振氢谱只有一个峰;F的核磁共振氢谱有3个峰,峰面积之比为2:2:3。已知:(其中R是烃基)

有关物质的转化关系如下图所示,请回答以下问题。

(1)A中不含氧的官能团的名称是 ;⑤的反应类型是 。G的结构简式为 ;G与Br2的CCl4溶液反应,产物有 种(不考虑立体异构)。
(2)反应②的化学方程式为 。
(3)E可在一定条件下通过 (填反应类型)生成高分子化合物,写出该高分子化合物可能的结构简式 (两种即可)。
(4)反应⑥的化学方程式为 。
(5)有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,写出所有符合条件的Y的结构简式 。Y与足量氢氧化钠溶液反应所得产物之一M,能与灼热的氧化铜反应,写出M与灼热的氧化铜反应的化学方程式 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号