湖南省怀化市高三第一次模拟考试理综化学试卷
化学已渗透到人类生活的各个方面。下列说法正确的是
| A.制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
| B.乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的 |
| C.垃圾焚烧法已成为许多城市垃圾处理的主要方法之一,利用垃圾焚烧产生的热能发电或供热,能较充分地利用生活垃圾中的生物质能 |
| D.为了防止中秋月饼等富脂食品氧化变质,延长食品保质期,在包装袋中常放入生石灰 |
对下列叙述的评价合理的是:
| 选项 |
叙述 |
评价 |
| A |
乙酸乙酯在H218O中水解,产物乙醇中将含有18O |
错,根据酯的水解规律,产物乙酸中将含有18O同位素,而乙醇则没有。 |
| B |
淀粉与20%的硫酸混合溶液在沸水浴中充分加热后滴加碘水无蓝色现象,则说明淀粉水解完全 |
错,淀粉水解后未加碱中和至溶液呈碱性。 |
| C |
用酸性高锰酸钾溶液除去甲烷中的乙烯气体 |
对,乙烯能与酸性高锰酸钾溶液反应,而甲烷不能与高锰酸钾溶液反应。 |
| D |
可以用新制的Cu(OH)2悬浊液鉴别乙醇溶液、乙酸溶液和葡萄糖溶液 |
错,用新制的Cu(OH)2悬浊液不能鉴别乙醇溶液和乙酸溶液。 |
下列有关实验装置进行的相应实验,能达到实验目的的是
| A.用图1装置制取并收集干燥纯净的NH3 |
| B.用图2所示装置可除去中NO的NO2 |
| C.用图3所示装置可分离CH3COOC2H5和饱和碳酸钠溶液 |
| D.用图4装置制备Fe(OH)2并能较长时间观察其颜色 |
-C3H7和-C3H7O取代苯环上的氢原子,形成的有机物中能与金属钠反应的同分异构体有
| A.10种 | B.15种 | C.30种 | D.36种 |
粗制的CuSO4·5H2O晶体中含有Fe2+。提纯时,为了除去Fe2+,常加入少量H2O2,然后再加入少量碱至溶液pH=4,即可以除去铁离子而不损失硫酸铜。下列说法不正确的是
| A.溶解CuSO4·5H2O晶体时要加入少量稀H2SO4 |
| B.加入H2O2,除Fe2+的离子方程式:2Fe2+ + H2O2 + 4OH- ="=" 2 Fe(OH)3 |
| C.由于CuSO4的催化作用,会使部分H2O2分解而损失 |
| D.调溶液pH=4的依据是当pH=4时Fe(OH)3沉淀完全,而Cu(OH)2还未开始沉淀 |
X、Y、Z、R、W是5种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族,Z、R、W同周期。下列说法错误的是
| A.原子半径:Z>R>W |
| B.气态氢化物稳定性:HmW>HnR |
| C.Y、Z、R三种元素组成的化合物水溶液一定显碱性 |
| D.X2W6分子中各原子均满足8电子结构 |
下列叙述正确的是
| A.常温下,10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 |
| B.常温下,向AgCl的饱和溶液中加入NaCl固体,有固体析出,且AgCl的Ksp变小 |
| C.在0.1 mol·L-1 CH3COONa溶液中,c(OH-)>c(CH3COOH)+c(H+) |
| D.常温下pH=4的NaHC2O4溶液中:c(H2C2O4)>c(C2O42-) |
某实验小组用下图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯)
反应原理: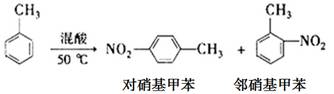
实验步骤:①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃-55℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到对硝基甲苯和邻硝基甲苯共15g。
相关物质的性质如下:
| |
密度/g·cm-3 |
沸点/℃ |
溶解性 |
| 甲苯 |
0.866 |
110.6 |
不溶于水 |
| 对硝基甲苯 |
1.286 |
237.7 |
不溶于水,易溶于液态烃 |
| 邻硝基甲苯 |
1.162 |
222 |
不溶于水,易溶于液态烃 |
(1)仪器A的名称是________。
(2)配制混酸的方法是 。
(3)若实验后在三颈瓶中收集的产物较少,可能的原因是: 。
(4)本实验采用水浴加热,水浴加热的优点是 。
(5)分离反应后产物的方案如下:
操作1的名称是 ,操作2中不需要用到下列仪器中的 。(填序号)
a.冷凝管
b.酒精灯
c.温度计
d.分液漏斗
e.蒸发皿
(6)本实验中邻、对硝基甲苯的产率为________(结果保留小数点后一位数字)。
某工厂废弃的钒渣中主要含V2O5、VOSO4、K2SO4、SiO2等,现从该钒渣回收V2O5的工艺流程示意图如下: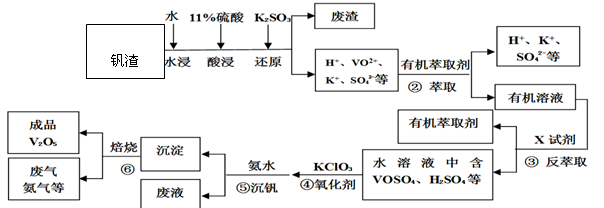
(已知:沉淀为(NH4)2V6O16,全钒液流储能电池是利用不同价态离子对氧化还原反应来实现化学能和电能相互转化的装置,②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂)。
R2(SO4)n(水层)+2nHA(有机层) 2RAn(有机层) + nH2SO4(水层)
2RAn(有机层) + nH2SO4(水层)
回答下列问题:
(1)(NH4)2V6O16中钒(V)的化合价为 ,①中产生的废渣的主要成分是 。
(2)工艺中反萃取所用的X试剂为 。
(3)为提高②中萃取效率,应采取的措施是 。
(4)请完成④中的反应离子方程式: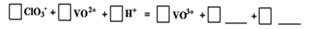
(5)成品V2O5可通过铝热反应来制取金属钒,写出该反应的化学方程式: 。
(6)将两个全钒液流储能电池串联后作为电源,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,装置如下: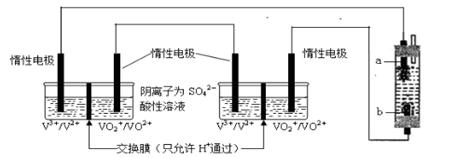
b为电解池的 极,全钒液流储能电池正极的电极反应式为 ;
若通过消毒液发生器的电子为0.2 mol,则消毒液发生器中理论上最多能产生 gNaClO。
CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天
然气(主要成分为CH4)与水进行高温重整制备合成气。
(1)已知:CH4、H2和CO的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol和-283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。用1 m3(标准状况)的甲烷与水蒸气在高温下反应制取合成气所需的热量为 (保留整数)。
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
①计算该反应第一次达平衡时的平衡常数K 。
②3min时改变的反应条件是 (只填一种条件的改变即可)。
(3)已知温度、压强、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示。
①图1中的两条曲线所示投料比的关系X1 X2(填“=”、“>”或“<”下同)。
②图2中两条曲线所示的压强比的关系:P1 P2。
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为 。
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 。
【化学——选修2:化学与技术】
某矿石中除含SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO,从该矿石中提取钴的主要工艺流程如下:
(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如图所示。考虑生产成本和效率,最佳的浸出时间为 小时,最佳的浸出温度为 ℃。
(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+ H2O+ Na2CO3= Na2Fe6(SO4)4(OH)12↓+ Na2SO4+ CO2↑
(3)“除钙、镁”的原理反应如下:MgSO4+2NaF=MgF2↓+Na2SO4;
CaSO4+2NaF=CaF2↓+Na2SO4。已知KSP(CaF2)=1.11×10-10、KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中的c(Ca2+)/c(Mg2+)= 。
(4)“沉淀”中含杂质离子主要有 ;“操作X”名称为 。
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,电池反应为LiCoO2+ C6 CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
【化学——选修3:物质结构与性质】
目前半导体生产展开了一场“铜芯片”革命——在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下: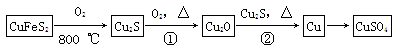
(1)基态铜原子的外围电子层排布为__________________,硫、氧元素相比,第一电离能较大的元素是________(填元素符号)。
(2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是________,其立体结构是______________。
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液 蓝色沉淀
蓝色沉淀 沉淀溶解,得到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式_______________________;深蓝色透明溶液中的阳离子内存在的化学键类型有 。
沉淀溶解,得到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离子方程式_______________________;深蓝色透明溶液中的阳离子内存在的化学键类型有 。
(4)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途,铜晶体中铜原子堆积模型为_____________;铜的某种氧化物晶胞结构如图所示,若该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞中铜原子与氧原子之间的距离为________cm。((用含d和NA的式子表示)。
【化学——选修5:有机化学基础】
芳香化合物A是一种基本化工原料,可以从煤和石油中得到。OPA是一种重要的有机化工中间体。A、B、C、D、E、F和OPA的转化关系如下所示:
已知:
回答下列问题:
(1)A的化学名称是 ;
(2)由A生成B 的反应类型是 。在该反应的副产物中,与B互为同分异构体的化合物的结构简式为 ;
(3)写出C所有可能的结构简式 ;
(4)D(邻苯二甲酸二乙酯)是一种增塑剂。请用A和不超过两个碳的有机物及合适的无机试剂为原料,经两步反应合成D。用结构简式表示合成路线
合成路线流程图示例如下:
(5)E→F的化学方程式为 ;
(6)芳香化合物G是E的同分异构体,G分子中含有醛基、酯基和醚基三种含氧官能团,G可能的同分异构体有 种,写出核磁共振氢谱中峰面积比3∶2∶2∶1的化合物的结构简式_________________
 粤公网安备 44130202000953号
粤公网安备 44130202000953号