在科学拓展性课程学习中,小柯做了如下实验:先在水槽里的支架上放两个小烧杯,一个盛有较多正在萌发的种子,另一个装有适量的NaOH溶液,再往水槽内注入一定量的水,最后用一个大烧杯罩住两个小烧杯(如图),持续一段时间后,观察到大烧杯内的水面上升,水槽的水面下降,为什么杯外的水会进入杯内呢?请分析实验过程,并结合所学知识作出解释。

过氧化钙(CaO2)是一种重要的化工产品,可用来改善地表水质、治理赤潮。过氧化钙产品中常含有氧化钙杂质。以下是某学习小组为测定过氧化钙产品纯度设计的实验,实验装置如图。

已知:CaO2是一种白色粉末,微溶于水,易溶于稀盐酸,且发生反应:
CaO2+2HCl═CaCl2+H2O2
实验步骤:实验前称取产品及MnO2共12.0g,先缓慢通入N2一段时间后,加热铜网至红热,再缓慢滴入过量稀盐酸,直至A中样品完全反应。继续缓慢通入N2,一段时间后停止加热,待C中铜网冷却后,停止通入N2.将锥形瓶中的剩余物过滤,洗涤,干燥,得到滤渣2.0g。
回答下列问题:
(1)MnO2与稀盐酸不反应。A中MnO2的作用是 。
(2)样品完全反应后,继续缓慢通入N2的目的是 。
(3)装置B的作用有:除去气体中的水蒸气、 。
(4)实验测得C装置中铜网增重1.8g,该产品中过氧化钙的质量分数为 。
某兴趣小组进行纯碱样品(杂质仅含NaCl)中Na 2CO 3质量分数的测定实验,主要操作流程如图:

(1)请指出图中过滤操作中的一处错误: 。
(2)为节约药品,可先向呈碱性的Na 2CO 3溶液中滴加无色酚酞试液,溶液呈 色,再向溶液中滴加CaCl 2溶液至颜色恰好消失,即可停止滴加。
(3)以下操作过程会导致Na 2CO 3质量分数测定值偏小的有 。
A.称量沉淀质量时忘记读取游码所示的值(不为零)
B.沉淀未完全烘干就进行称量
C.溶解时,充分搅拌后,样品未能完全溶解即进行下步操作。
正确进行实验操作,合理改进实验装置,是科学素养的重要方面.请回答下列问题:
(1)如图甲是实验室制取CO 2的装置,实验中收集集满一瓶CO 2后,应将盖有玻璃片的集气瓶 (选填"正放"或"倒放")在桌面上.
(2)有两位同学对图甲中的气体发生装置进行了简化,简化后的装置如图乙和图丙所示,其中可行的是 .
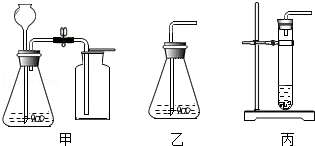
某实验小组设计如图所示装置,进行气体的制备和性质实验
实验试剂(用品):大理石、氯化钠、二氧化锰、硝酸铵固体、稀盐酸、过氧化氢溶液、蒸馏水、木条、火柴、酒精灯。
选择合适的试剂(用品)按如下步骤进行实验。
(1)组装仪器, (填必要的操作),加入药品。
(2)关闭止水夹,推动注射器,注入液体,观察到装置A中有大量气泡冒出,气球胀大。
(3)打开止水夹,观察到装置B中导管口有气泡冒出,澄清石灰水未变浑浊,装置A中产生气体的化学方程式为 要进一步确认该气体的成分还需进行的操作是 ,取下装置B中双孔塞,将红热的细铁丝由上到下缓慢地伸入到B装置的玻璃瓶中,细铁丝剧烈燃烧,写出反应的化学方程式 。
(4)更换装置A中的固体和液体药品,重复步骤2中的操作,能观察到相同的实验现象。打开止水夹,观察到装置B中导管口有气泡冒出,澄清石灰水变浑浊,写出装置B中反应的化学方程式 ,装置A中选择的固体和液体分别为 和 。
(5)继续更换装置A中的药品重复上述操作,观察到装置A中没有气泡冒出,气球变瘪。装置A中选择的固体和液体分别为 和 。

青少年过多摄入蛋糕里的人造奶油会产生一种影响身体发育的反式脂肪酸,其化学式C18H34O2.请计算:
(1)该反式脂肪酸分子中碳、氢、氧的原子个数比为 。
(2)141g该反式脂肪酸分子中含氢元素的质量为 g。
某金属冶炼厂的管道烟泥中含有少量铜、锌、硫等单质。现欲回收铜和锌,并对硫进行环保处理,主要步骤如图所示:

已知:加热的条件下,Zn、Cu都可以与氧气反应生成相应的金属氧化物。
(1)烟泥最初处理需要除油污,用洗涤剂除油污的过程中发生了 现象。步骤①产生的废气B中,一定含有的有害气体是 (填化学式)。环保处理最好釆用的试剂是 (填字母序号)。
A、浓硫酸 B、食盐水 C、石灰乳
(2)写出步骤④中得到铜的化学方程式 ,它属于基本反应类型中的 反应。
(3)步骤③和④中主要操作的名称是 。
(4)我国古代就制得了一种外观似金子的锌和铜的合金,也就是黄铜,它的硬度比纯铜 (填“高”或者“低”)。
(5)取少量的溶液C,往其中加入一定质量的镁粉,充分反应后过滤,得到滤渣和滤液。往滤渣中加入稀盐酸有气泡产生,则滤液中一定没有 (填字母序号)。
A、硫酸镁 B、硫酸锌 C、硫酸铜 D、硫酸铜和硫酸锌
中和反应在日常生活中应用广泛,下列是稀盐酸和氢氧化钠溶液反应的微观示意图。回答以下问题:
(1)分析图中反应前后没有发生变化的微粒是 、 ;反应的实质是 。
(2)如果规定上述反应后溶液的pH<7,显酸性。请你设计一个实验方案证明溶液显酸性:
实验操作 |
实验现象 |
实验结论 |
①
|
②
|
显酸性 |
已知A~G为初中化学常见的七种物质。其中D的固体叫做“干冰”;B中只含两种元素,C与E不含相同元素。各种物质间的反应和转化关系如图所示(“﹣”表示相连的两种物质之间可以发生反应,“→”表示一种物质可以转化为另一种物质,反应条件、部分反应物和生成物已略去)。
请分析后回答:
(1)D的化学式 。
(2)B与G反应的化学方程式 。

2017年5月,我国在南海海域成功开采可燃冰。可燃冰外观像冰,主要成份是甲烷水合物(甲烷分子和水分子组成),可表示为 CH4•nH2O,在开采过程中,若甲烷泄漏会导致严重的温室效应。
某化学兴趣小组的同学对甲烷燃烧的产物产生了兴趣,设计实验探究:
[提出问题]甲烷燃烧后生成哪些物质?
[查阅资料]①含碳元素的物质完全燃烧生成CO2,不完全燃烧生成CO;
②白色无水CuSO4粉末遇水变蓝色;
③CO与人体内的血红蛋白结合,会造成人中毒缺氧。
[猜想与假设]猜想一:CO2、H2O. 猜想二:CO、H2O;猜想三:CO2、CO、H2O
[实验探究]将甲烷在一定量的纯净氧气中燃烧的产物依次通过C﹣G装置(部分夹持、固定装置省略)进行验证:
(1)装置A、B中标有数字的仪器名称 ① ,② 。

若选用过氧化氢溶液和二氧化锰来制取氧气,应选用的发生装置是 ;该反应的化学方程式为 ;
(2)实验过程中观察到C中白色粉末变为蓝色,D、G中澄清石灰水变浑浊,F中红色粉末变成黑色,由此推断猜想 成立。
(3)实验过程中D装置的作用是 ;该反应的化学方程式是 。
(4)实验过程中用纯净O2而不用空气的原因是 。
(5)实验过程中C、D装置的顺序不能颠倒,原因是 。
[反思与交流]日常生活中,使用含碳燃料一定要注意通风,防止 中毒。
Ca(OH)2变质得到Ca(OH)2和CaCO3的混合物。李琳同学设计了如图的实验装置来测定CaCO3的含量。她用气密性良好的装置装上药品并通一会儿N2后关闭止水夹,再打开分液漏斗活塞。提示:碱石灰(可以吸收CO2和H2O)、浓硫酸均足量,稀盐酸不考虑其挥发性。

(1)通入N2的原因之一是N2的化学性质 (填“活泼”或“不活泼”)。
(2)甲装置中发生中和反应的化学方程式为 。
(3)浓硫酸的作用是 。
(4)测定CaCO3的含量需要测定两个物理量,其中一个物理量为样品的质量。
①另一个物理量为 (填序号)。
A.滴下的稀盐酸质量
B.反应前后乙装置增加的质量
C.反应前后丙装置增加的质量
D.反应前后丁装置增加的质量
②若去掉丁装置,测得CaCO3含量 (填“偏高”、“偏低”或“不变”)。
③甲装置中反应结束后打开止水夹再通入一会儿N2的目的是 。
(1)用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程溶液pH变化曲线如图所示:
①该反应的化学方程式是 ;
②该实验操作是将 (写溶质的化学式)溶液逐滴加入到另一种溶液中。
(2)若用稀硫酸代替(1)中的稀盐酸,将稀硫酸逐滴加入至盛有氢氧化钠溶液的烧杯中,当滴加到一定量并充分反应时,请对烧杯中溶质成分进行探究。
【提出问题】此时烧杯中的溶质成分是什么?
【猜想与假设】Ⅰ:Na 2SO 4Ⅱ: Ⅲ:Na 2SO 4和NaOH
【实验与探究】
| 实验步骤 |
实验现象 |
实验结论 |
| 取少量上述烧杯中的溶液于试管中,滴加 溶液 |
|
猜想Ⅲ正确 |

氧气在中学化学中有着举足轻重的地位。
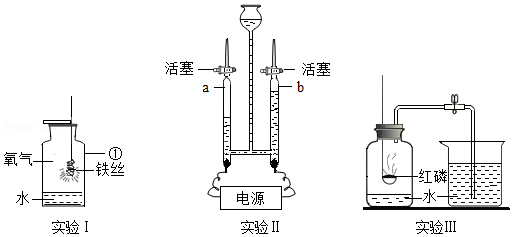
(1)实验Ⅰ中仪器①的名称为 ,现象为铁丝剧烈燃烧,火星四射,产生 色固体。
(2)实验Ⅱ为电解水制氧气,发生反应的化学方程式为 。气体a在电源的 (填“正”或“负”)极端产生。
(3)实验Ⅲ为测定空气中氧气含量的实验,在瓶内加入少量水、并将水面上方空间分为5等份,接下来的实验步骤依次为 (填序号),最后打开弹簧夹。
①冷却到室温
②弹簧夹夹紧橡皮管
③点燃燃烧匙内的红磷后,立即伸入瓶中并把塞子塞紧
某固体粉末可能含有氯化镁、硫酸钠、硝酸钠、硫酸铜和碳酸钙中的一种或几种,为确定其成分,某化学实验小组同学进行了如下实验。
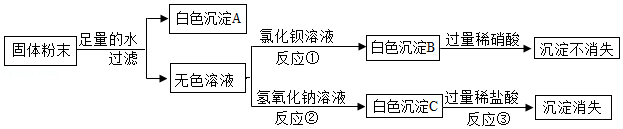
回答下列问题:
(1)白色沉淀C是 (填化学式)。
(2)反应①的化学方程式为 。
(3)原固体粉末中一定含有的物质是 (填化学式),一定不含的物质是 (填化学式)。