连云港碱厂年产纯碱120万吨,是我国三大纯碱生产企业之一。它的产品除了纯碱外,还有氯化钙和碳酸氢钠。该厂生产纯碱的工艺流程可简单表示如下:

其生产过程中涉及的主要化学反应有:
①
↓
②
↑
请回答:
(1)①"碳化"过程中需要的
,可由石灰石高温煅烧得到,该反应的化学方程式为。
②实验室中,通常用稀盐酸与石灰石反应制取
气体,不选用浓盐酸的理由是;干燥
气体,可用的干燥剂是(填字母)。
| A. |
浓硫酸 |
B. |
固体氢氧化钠 |
C. |
生石灰 |
(2)①该厂"过滤"所得的
可作化肥中的肥,它也可与
在加热时发生反应生成产品
,同时还有
和
生成,写出该反应的化学方程式:。
该厂的另一种产品碳酸氢钠俗称,它的重要用途有(只写一种)。
②实验室进行"过滤"操作时,下列说法正确的有(填字母)
| A. |
使用的漏斗叫长颈漏斗 |
B. |
液面应低于滤纸边缘 |
C. |
玻璃棒应不停搅拌 |
D. |
漏斗下端的管口要紧靠烧杯内壁 |
(3)某化学兴趣小组的同学为了测定该厂生产的纯碱是否属于优等品(国家规定:优等品中碳酸钠的质量分数不低于99.2%),设计了如下两种实验方案:
方案一:称取样品10.65
,加水完全溶解,向其中加入足量的氯化钡溶液,充分反应后,过滤、洗涤,干燥得固体19.70
。通过计算(写出计算过程)判断该厂的产品是否属于优等品。(杂质可溶于水且不与氯化钡反应)
方案二:用下图所示的装置,通过准确测量排出水的体积,也可计算样品的纯度。该装置中
仪器的名称是,但实验后同学们发现所测的碳酸钠的纯度偏低,造成此结果的原因可能是。(装置的气密性良好)

亮亮做家务时接触到下列用品。
| 用品 |
脱氧剂 |
洁厕灵 |
炉灶清洁剂 |
| 有效成分 |
还原铁粉 |
盐酸 |
氢氧化钠 |
(1)他清理垃圾时发现一袋脱氧剂,拆开后看到还原铁粉已生锈,铁生锈的原因是。
(2)他选用洁厕灵清除水垢(主要成分是碳酸钙),用化学方程式表示其原理。
(3)他清洗炉灶时戴上橡胶手套,以防清洁剂与皮肤直接接触,其原因是。
(4)做完家务,他用
泡腾片冲了一杯饮料。下列
泡腾片的主要成分中,属于有机物的是(填字母序号)。
A.维生素C( )
)
B.柠檬酸( )
)
C.碳酸氢钠( )
)
学完第十、十一单元后,小亮对家里面的几种清洁剂进行了研究.下表是小亮家的几种清洁剂的功能和有效成分.
| 清洁剂 |
彩漂液 |
漂白水 |
| 功能 |
漂洗衣物,使色彩鲜艳 |
漂除衣物污渍 |
| 有效成分 |
H2O2 |
NaClO |
根据表中信息,请你和小亮一起回答下列问题.
(1)这两种清洁剂的有效成分中,属于氧化物的是 (填化学式).
(2)在盛有少量“彩漂液”的试管中,加少量二氧化锰,观察到的现象是 ,其反应的化学方程式为 .
(3)小亮同学在使用“洁厕灵”去除水垢时,发现有大量的气泡产生.联想水垢的主要成分是碳酸钙,小明猜想“洁厕灵”的成分中可能有酸.
①为证实自己的猜想,小亮从家中又找来两类不同的物质进行实验:
实验一: ;
实验二: .
经实验,小亮得出“洁厕灵”的有效成分中一定有酸的结论.
②小亮想试制一瓶“洁厕灵”,你认为盐酸、硫酸这两种酸中的 更合适,理由是
③结合上面对“洁厕灵”的了解,在使用“洁厕灵”时应注意
(4)“洁厕灵”与“漂白水”不能混用.二者若混合其有效成分之间能发生化学反应,产生氯化钠、水和有毒的氯气(Cl2),化学方程式为 .
小明在实验手册上看见了如图所示的装置图,实验现象一栏写着:“黑色固体变红,澄清石灰水变浑浊”
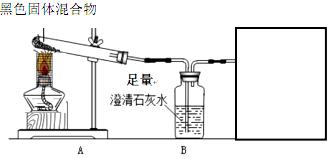
(1)推测实验中一定会发生的反应有 、 (填化学方程式)。方框中需补充一个装置,是因为A中还可能发生 (任填一个化学方程式);
(2)对该实验分析错误的是 (填序号);
①网罩的作用是集中火焰,提高温度
②A中固体减少的质量理论上等于B中增加的质量(假设只生成一种气体)
③实验结束后应先熄灭酒精灯,冷却后再将导气管从澄清石灰水中取出
④在方框导管口处放置一盏燃着的酒精灯,既可进一步确证生成气体的成分,又可防止尾气污 染空气
(3)装置补充完整后,若实验中还能观察到导管口处有气体燃烧,火焰呈蓝色,则A处试管中发生反应的化学方程式为 。
在学习"金属的冶炼"时,某学习小组用如图所示的装置测量氧化铜样品中氧化铜的质量分数,实验所取氧化铜样品质量为10克。(所含杂质不参加反应)

(1)该实验利用了一氧化碳的性,玻璃管内观察到的现象是。
(2)甲同学的方法:先测出氢氧化钠浓溶液的质量为50克,待反应完全后再次称量,质量为54.4克。请你计算样品中氧化铜的质量分数。(一氧化碳不与氢氧化钠溶液反应)
(3)乙同学的方法:先称量出玻璃管及样品的总质量为
,待反应完全后再次称量,质量为
,利用
的值,求出样品中氧化铜的质量分数。其中
的值是指的质量。
(4)同学们查阅到
除了具有可燃性、难溶于水等性质外,还具有毒性。因此,本实验中还需对尾气进行处理。请你提出一种处理方法。
海洋是人类千万年来取之不尽、用之不竭的巨大资源宝库,开发前景广阔。
(一)目前海水淡化的方法很多,在世界范围之内能做到规模化和产业化的主要是膜法和 。
(二)海底不仅蕴藏着大量的煤、石油、天然气等化石燃料,人们还在海底发现了一种新型矿产资源 ,被科学家誉为“21世纪能源”。
(三)海水“晒盐”。海水提取食盐的方法主要为“盐田法”,其过程如下:
图中②是 池,上图中的“母液”是氯化钠的(填“饱和”或“不饱和”) 溶液。
(四)镁成为21世纪重要的轻型环保材料,我国含有非常丰富的镁资源,占地球表面积的70%的海洋是天然的镁元素宝库,从海水中提取镁的流程如下:
(1)在海水中加入的试剂a是___________(填名称),操作①的名称为 ,在此操作中用到玻璃棒,其作用是 。
(2)从海水中提取镁过程中涉及到的化学反应方程式为 、 、 。
(3)金属镁在高温下与氮气反应生成氮化镁,在氮化镁中氮元素的化合价为-3价。据此写出氮化镁的化学式 。
(五)海水“制碱”。下图是氨碱法制纯碱的工艺流程。
(1)流程图Ⅰ是依次向粗盐水中加入Ca(OH)2和Na2CO3,二者加入的顺序能否颠倒?为什么?_____________________________________________________。
(2)用一个化学方程式表示出流程图Ⅱ中发生的总反应_________ ___________。
(3)工业生产纯碱的流程中,碳酸化时溶液中析出碳酸氢钠而没有析出氯化铵的原因是________________________________________。
镁是一种用途广泛的国防金属材料,目前大部分镁都是利用从海水中提取镁盐制得的,工艺流程如下图所示:
请你根据上述材料,回答下列问题:
(1)操作①的名称是 (填“溶解”、“过滤”、“蒸发”之一)。
(2)试剂C中溶质的化学式是 。
(3)从海水中提取MgCl2时,经历了“MgCl2→Mg(OH)2→MgCl2”的转化过程,请分析这样做的目的是 。
(4)某校化学活动小组在实验室用蒸馏水和氯化镁配制了氯化镁溶液,模仿海水进行氯化镁含量的测定。学习小组的同学取该海水样品190 g,向其中加入氢氧化钠溶液,产生沉淀的质量与所加氢氧化钠溶液质量的关系曲线如图所示。请计算:上述海水样品中氯化镁的溶质质量分数是多少?(精确到0.1%)
氮化镁是一种应用范围非常广泛的无机化合物,它可用于制备高硬度、高热导、抗腐蚀、抗磨损和耐高温的其它元素的氮化物,制备特殊的陶瓷材料等。某校化学研究小组用镁与氮气反应制备氮化镁(Mg3N2),并用实验方法测定氮化镁的纯度。
I.制备氮化镁
【查阅资料】
①(NH4)2SO4+2NaNO2 2N2↑+Na2SO4+4H2O,该反应为放热反应。
2N2↑+Na2SO4+4H2O,该反应为放热反应。
②饱和硫酸亚铁溶液能吸收氧气;稀硫酸能吸收氨气。
③在常温下或温度不高的条件下镁几乎与水不反应。
【实验】
制备氮化镁的装置示意图如下:
(1)D装置的作用是 ,G装置的作用是 。
(2)E装置中发生反应的化学方程式为 。
(3)实验时先进行 (选填“A”或“E”)处加热,理由是 。
II.测定氮化镁的含量
氮化镁是浅黄色粉末,极易与水反应生成Mg(OH)2沉淀和NH3,反应的化学方程式为 ,氮化镁(Mg3N2)中氮元素的化合价是 。
【定性分析】
步骤一:取少量氮化镁样品于试管中,加足量蒸馏水,试管底部有沉淀生成,试管口闻到有刺激性气味的气体生成。
步骤二:弃去上层清液,加入稀盐酸,观察到沉淀全溶且冒气泡。该步骤中产生气泡的化学方程式为 。
【定量测定】
按下图实验装置进行实验:
(4)取氮化镁样品16g进行实验,I装置增重3.4g,求该样品中氮化镁的质量分数(请写出计算过程)。
(5)球形干燥管的作用是 。
硫酸亚铁铵晶体俗称摩尔盐,化学式为FeSO4·(NH4)2SO4·6H2O,在制药、电镀方面有广泛的应用。某化学兴趣小组的学生用含有少量铜的废铁屑制备硫酸亚铁铵晶体,流程如下:
资料:①硫酸亚铁铵晶体易溶于水,不溶于酒精;硫酸亚铁铵晶体在100℃~110℃时分解。
②相关物质的溶解度(单位:g)如下表:
| 温度/℃ |
FeSO4 |
(NH4) 2SO4 |
FeSO4·(NH4)2SO4·6H2O |
| 10 |
20.0 |
73 |
17.2 |
| 20 |
26.5 |
75.4 |
21. 6 |
| 30 |
32.9 |
78 |
28.1 |
请回答下列问题:
(1)实验前,先用碳酸钠溶液浸泡废铁屑表面油渍。碳酸钠溶液可除去油渍是因为碳酸钠溶液的pH 7(选填“>”、“<”或“=”)。
(2)①中发生反应的化学方程式为 。
(3)操作①中过滤时,要趁热进行的原因是 ,过滤后得到的固体中一定含有的物质是 。
(4)操作③中使用无水酒精洗涤,可快速晾干。这样做的优点是 (填字母)。
A.避免用水洗涤所造成的晶体损耗
B.酒精易挥发,可低温晾干晶体
海洋是人类宝贵的自然资源,从海水中可以得到粗盐。
(1)称取5.0g粗盐,逐渐加入10mL水中,边加边用玻璃棒搅拌,一直加到粗盐不再溶解为止。还需要进行的实验步骤依次为:①称量剩余粗盐、② 、③ 、④称量精盐、⑤计算产率。
(2)下图是某工厂利用粗盐水生产纯碱的工艺流程图。
①下列说法正确的是 (填字母)。
| A.流程Ⅰ中加入溶液的顺序不能改变 |
| B.流程Ⅰ将粗盐水中的SO42-、 Mg2+、Ca2+转化为沉淀 |
| C.流程Ⅰ后过滤得到三种沉淀 |
| D.流程Ⅲ中发生的是分解反应 |
②流程II中发生的主要反应为NH3+CO2+H2O NH4HCO3 ,
NH4HCO3+NaCl NaHCO3↓+NH4Cl 。
20℃时,向100g水中加入11.7g NaCl和15.8g NH4HCO3,充分反应后,理论上从溶液中析出晶体的质量为 g(20℃时,NaHCO3的溶解度为9.7g, NH4Cl的溶解度为37.2g)。
某同学欲用①NaOH溶液、②Na2SO4溶液、③Na2CO3粉末、④铁钉、⑤Ba(NO3)2溶液分别与稀H2SO4混合来验证复分解反应发生的条件。(如下图)
(1)从物质类别和构成的角度分析,铁钉、 与稀H2SO4混合的实验没有必要做。
(2)上述物质中 能与稀硫酸发生复分解反应,但是没有明显现象;为证明两者能够反应,你的做法是 ;
(3)Na2CO3粉末和稀H2SO4能发生反应,是因为反应中有 生成;
(4)依据常见酸、碱、盐的溶解性表(室温),某物质能与稀H2SO4发生中和反应,同时生成水和沉淀,写出反应的化学方程式 。
人类的日常生活和工农业生产离不开水。请回答:
(1)水(填"属于"或"不属于")人类所需的六大基本营养素之一。
(2)含有较多可溶性钙、镁化合物的水叫做(填"软水"或"硬水")。
(3)下列净化水的单一操作中,相对净化程度较高的是(填字母)
| A. |
静置沉淀 |
B. |
吸附沉淀 |
C. |
蒸馏 |
(4)水在通电的条件下可以分解,写出该反应的化学方程式。
(5)甲和乙两种固体物质的溶解度曲线如下图所示,回答下列问题:

①在℃时,甲和乙两种物质的溶解度相等。
②将
℃时等质量的甲和乙两种物质的饱和溶液分别降温到0℃,析出固体质量较少的是(填"甲"或"乙")。
③
℃时,将60
甲物质放入100
水中,充分搅拌,所得溶液的溶质质量分数
(甲)与同温下乙物质的饱和溶液的溶质质量分数
(乙)大小关系为(填字母)。
| A. |
(甲)< (乙) |
B. |
(甲)> (乙) |
C. |
(甲)= (乙) |
D. |
无法确定 |
对于氢氧化钠溶液而言,溶质的质量分数越大,溶液的碱性越强。
(1)若要测定该溶液的酸碱度,可选用下列选项中的 。
① 无色酚酞试液 ②紫色石蕊试液 ③pH试纸
(2)常温下,5%的氢氧化钠溶液的pH 2%的氢氧化钠溶液的pH(填“小于”、“大于”或“等于”)。
(3)如果要减小氢氧化钠溶液的pH,你采取的方法有:
①不发生化学反应的方法是 ;
②发生化学反应的方法有 、 (答出两种,所选用物质的类别不同)。
某氯化钾样品含有杂质氯化钙和氯化镁,设计提纯的流程图如下:

请认真分析流程中各步骤的信息作答:
(1)溶剂
是;
溶液中溶质的化学式为:。
(2)蒸发操作的目的是除去(填物质的化学式)。
(3)写出加入过量
溶液反应的化学方程式:。
炼铁的原理是利用一氧化碳与氧化铁反应。某同学利用该原理设计了一个实验,实验装置如下图所示:请对实验进行分析并回答:
(1)写出仪器名称①_________;② 。
(2)实验开始前,先通入一氧化碳的目的是 ;实验过程中玻璃管里固体物质的颜色变化是___ ____;
(3)观察到B中的现象是_____________;
(4)C处燃着酒精灯的作用是_______________________。