要除去NaCl样品中少量的Na2SO4和CuCl2杂质,请根据所提供的试剂:NaOH溶液、稀HCl、BaCl2溶液分析并完成下列有关问题:(1)第一步:取NaCl样品溶于水,加入过量的 试剂,完全反应后,过滤,除去CuCl2杂质;所发生的化学反应方程式是 ;
(2)第二步:在第一步所得滤液中加入适量的 试剂,完全反应后,再过滤,除去样品中 的杂质;
(3)第三步:在第二步所得滤液中加足量的 ,完全反应后,再进行
操作,最后得到NaCl固体.
已知某固体混合物A中可能含有
、
、
、
、
五种物质中的两种或多种。按下述步骤进行实验探究,观察实验现象,并加以分析推理(设过程中所有发生的反应都恰好完全反应)。
I.取一定质量的该固体混合物A放入一洁净烧杯中,向其中加入适量
溶液,搅拌,待烧杯中物质充分反应后,过滤,得红褐色沉淀
和滤液
。
Ⅱ.另取一定质量的该固体混合物A放入另一洁净烧杯中,向其中加入适量
溶液,搅拌,待烧杯中物质充分反应后,过滤,得白色沉淀
和滤液
。
III.将所得滤液C和滤液E充分混合,再向混合后的溶液中加入适量
溶液,待充分反应后,过滤,得白色沉淀
和滤液
。
Ⅳ.根据上述实验过程和发生的现象做出相应推理,填写以下空白:
(1)在固体混合物A里,上述五种物质巾肯定存在的物质是(写化学式)
(2)写出步骤III中生成白色沉淀F的1个化学方程式
(3)在滤液
中,含有的金属阳离子共有种,该滤液中肯定存在的酸根离子。
(4)在混合物
里,上述五种物质中肯定不存在的物质是(写化学式)。得出此结论的理由是。
老师用如图所示装置为同学们做如下实验:A装置集气瓶中装有体积比约为1∶1的
氮气和气体a的混合气体,注射器中装有足量的无色溶液b;B装置中盛有少量紫色石蕊溶液;C装置中盛有适量生锈的铁钉;D装置中盛有足量的稀硫酸。、
(1)关闭活塞K1、K2,将注射器中的溶液b挤入瓶中,打开活塞K1,看到B中溶液进入A中后溶液变为蓝色,B中长导管脱离液面。请回答:
①若a气体是二氧化碳,则b是 溶液(填化学式)。
②若b是水,则气体a可能是 (填化学式)。
(2)保持K1开启状态,并打开K2,一段时间后关闭K2,整个过程中,观察到D中的现象是 (填编号,共2分);
A.广口瓶内液面下降 B.长颈漏斗内液面上升 C.长颈漏斗下端有气泡
写出C装置中反应的化学方程式是 。
一定条件下, 与 反应会生成三种氧化物。某兴趣小组用如下装置探究该反应。
已知
,
均能使澄清石灰水变浑浊。

(1)仪器的名称是
。
中
的化合价是。
(2)装置
中
的分解会生成一种气体和一种相对分子质量为100的盐,则
中反应的反应化学方程式。
(3)实验时观察到装置
中紫红色褪去,装置
中溶液变浑浊,则在
和
中反应的气体分别是﹑。
(4)装置
中反应的化学方程式是。装置
的作用是。
(5)该装置的明显不足之处是。
食盐是一种重要的化工原料。请回答下列问题。
(1)请完善实验室除去粗盐中泥沙等难溶性杂质的实验步骤。
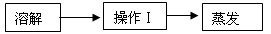
①操作Ⅰ所用的玻璃仪器有:烧杯、玻璃棒和。
②在蒸发过程中,待时,停止加热,利用余热将滤液蒸干。
(2)由于粗盐中含有少量
,
、
等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图。
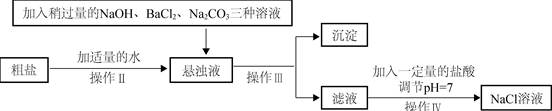
①加入稍过量的
溶液除了能除去粗盐中的
外,它还有一个作用是(用化学方程式表示)。
②通过操作Ⅲ所得滤液中的溶质有(用化学式表示)。
(3)若有溶质质量分数为10%的氯化钠不饱和溶液100 kg,要将其变成20 ℃时氯化钠的饱和溶液,以满足化工生产的需要,可采用的最简便方法是。已知:20 ℃时氯化钠的溶解度为36g。
为了制取
并验证它的性质,张林同学设计并进行了下图所示的实验,请根据要求回答有关问题。

(1)仪器
的名称是。
(2)
中玻璃管内发生化学反应的方程式为,酒精灯加上网罩的作用是。
(3)
中石蕊溶液始终没有变红,则
装置中
最有可能是(填序号)。
| A. |
稀硫酸 |
B. |
澄清石灰水 |
C. |
氢氧化钠溶液 |
(4)尾气的处理方法可以是。为了证明
中反应后的溶液里含有
,张林同学向溶液中滴加少许
溶液,结果没有观察到白色沉淀,你推测是(填物质的名称)的干扰。
宁波有较长的海岸线,每年能生产大量的食用盐。从海水中结晶的食盐一般混有
、
、
等杂质,为了除去上述杂质,设计了如下实验方案:先将固体溶解,然后向溶液中依次加人过量的
、
、
溶液,充分反应后过滤,将滤液蒸发结晶,得到较纯净的食盐。
(1)溶解、过滤和蒸发操作中都要用到玻璃棒。过滤时,玻璃棒的作用是。
(2)加入
溶液的目的是为了除去杂质。
(3)以上方案不够完善.应在过滤后增加一个步骤:往滤液中加入适量的。
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的
、
、
M等,工艺流程

根据上图回答下列问题:
(1)将菱锌矿研磨成粉的目的是。
(2)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是
、
和
,相对分子质量是89,针铁矿中铁原子数︰氧原子数︰氢原子数=。
(3)请写出氢氧化锌和稀硫酸反应的化学方程式。该反应的基本类型是.
(4)"滤液3"之前加入锌粉的目的是.
(5)"滤液3"之后的操作依次为、干燥。
(6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于×100%。
有一包白色粉末可能由
、
、
、
、中的一种或多种物质组成。小明为了探究其成分,设计并完成了如下图所示的实验。

根据以上实验,回答:
操作①是
原固体粉末中一定没有的成分是
生成沉淀A的化学方程式是
根据上述实验(填'能'或'不能')确定原固体粉末中含有 、 。
根据下列数型图像回答:

(1)图一是用盐酸和氢氧化钠进行中和反应时,反应过程中溶液的pH变化曲线。向盐酸中加入的氢氧化钠溶液质量为mg时,所得溶液中含有的离子为(填离子符号)
(2)图二是20℃时,取10mL10%的NaOH溶液于烧杯中,逐滴加入10%的盐酸,随着盐酸的加入,烧杯中溶液温度与加入盐酸体积的变化关系
①由图可知中和反应是放热反应,你的依据为②甲同学用氢氧化钠固体与稀盐酸反应也能得到相同结论,乙同学认为不严密,因为
(3)图三是a、d、c三种物质的溶解度曲线。a与c的溶解度相交于P点,据图回答:
①t1℃时,接近饱和的c物质溶液,在不改变溶液质量的条件下,可用的方法达到饱和状态
②将t2℃时,150g a物质的饱和溶液降温到t1℃时。可以析出g a物质。
(4)下图托盘天平两边是等质量的铁和镁分别跟等质量等浓度的稀硫酸反应,反应时间t与生成氢气质量m的变化关系如图四。

试回答:从开始反应到不再产生气体为止,天平指针偏转情况是
某化学兴趣小组用一氧化碳与氧化铁的反应来探究炼铁的原理,装置如下图所示,请回答有关问题:


实验进行一段时间之后,A玻璃管内观察到的现象是
B装置中氢氧化钠溶液的作用是。
为避免将
排放到空气中,并回收利用
,方框中连接的是C和D装置,导管接口的连接顺序应为a→除
外,还有氢气等物质可以还原
,某同学设计了用金属锌粒与稀硫酸反应制取氢气的实验装置,如右图所示:
①制取氢气的反应方程式为②用E和F装置制取二氧化碳,F装置与E装置比较,优点是
南海、钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源。
(1)海水制盐。从海水制取的粗盐中含有泥沙、硫酸镁和氯化钙等杂质,为得到较纯的氯化钠,将粗盐溶于水,然后进行如下操作:a.加过量的
溶液;b.加稍过量的盐酸;c.加过量的
溶液;d.过滤;e.蒸发。正确的操作顺序是(填字母)。加
溶液的作用是除去。
(2)海水淡化。下图是一个简易的蒸馏法淡化海水的装置。证明得到的水是淡水的方法是。

(3)海水制镁。从海水中提取金属镁的过程如下图所示:

在上述转化过程中发生中和反应的是 (填反应顺序号)。海水中本身就含有氯化镁,则①、②两步的作用是 。
(4)海水"制碱"。氨碱法制纯碱是先通过化学反应生成
和
,
结晶析出,再加热
制得纯碱。
①氨碱法制纯碱中生成
和
的化学方程式为 ;
②反应中生成
和
的质量比为84∶53.5,
和
的溶解度曲线如图所示。请分析
结晶析出而
没有结晶析出的原因是 。

燃煤产生的烟气中含有二氧化硫,直接排放会污染空气,它与水反应形成酸雨污染环境,某科研小组利用海水除去二氧化硫,其工艺流程见下图:

请回答下列问题:
(1)二氧化硫中硫的化合价是。
(2)用熟石灰中和稀硫酸的化学方程式是。
(3)亚硫酸(
)被空气中氧气氧化为硫酸,写出反应的化学方程式。
(4)为了研究脱硫率(脱硫率是已除去的二氧化硫的量占总二氧化硫量的百分比--与温度、烟气中
浓度的关系,他们进行了探究实验。实验结果如下:
| 实验序号 |
温度/℃ |
烟气中 浓度/ | 脱硫率/% |
| I |
23 |
2.5% |
99.5 |
| II |
23 |
3.2% |
97.1 |
| III |
40 |
2.5% |
94.3 |
由表中实验数据可得出的结论是。
(5)目前,科学家正在研究在一定条件下将乙烯(
)和烟气混合除去二氧化硫,其反应的过程可分为如下三步:
第一步:
与
反应生成
第二步: 与 反应生成
第三步:
与
反应生成
和
。
①反应中
的作用是。
②除去二氧化硫的总反应的化学方程式是。
通过一年的化学学习,你已经掌握了实验室制取气体的有关规律,以下是老师提供的一些实验装置。请结合下图回答问题:
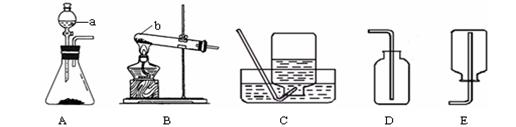
(1)写出图中标号的仪 器名称:a ;b ;
(2)写出实验室用A装置制取二氧化碳的符号表达式 ;若用B装置制取氧气,在试管口要塞 ,其原因是 ;
(3)通过查阅资料得知:
①氨气(NH3)是一种密度比空气小且极易溶于水的气体,其水溶液称为氨水;
②氨气在加热条件下能与氧化铜反应生成铜、水和空气中含量最多的气体。
小芳同学加热氯化铵和氢氧化钙的固体混合物制取氨气,她应选择的反应的发生装置是 ,收集装置是 。(填字母编号)
(4)小芳将收集满氨气的集气瓶倒扣在滴有无色酚酞的水中,观察到的现象是 ,
(5)请写出氨气和氧化铜反应的符号表达式 。
粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等).某班同学在粗盐提纯实验中,为把少量可溶性杂质
,
一并除去,将教材中实验方案修改设计如下,请据此回答问题:

(1)实验操作A的名称是,该操作的目的是.
(2)写出步骤③中发生反应的主要化学方程式 ;步骤⑥的作用是.
(3)小刚同学认为该方案实际得到的氯化钠可能比粗盐中含有的氯化钠要多,请你为他找出理由:.