相同质量的M、N两种活泼金属,分别与足量质量分数为8%的盐酸反应(M、N在生成物中均为+2价),生成H2质量和反应时间的关系如图。C下列叙述正确的是
| A.金属的活泼性N>M | B.两个反应生成H2的体积相等 |
| C.相对原子质量N>M | D.两个反应消耗盐酸的质量一定相等 |
(1)考古人员在发掘出来的文物中,发现金手镯完好无损,铜镜面有少量钢锈,铁器表面则锈迹斑斑.根据以上现象,你能得到的结论是 .
(2)铁器生锈是铁与 共同作用的结构,写出防止铁制品生锈的一种方法 .
(3)请你设计一个实验方案,比较铝、铁、铜的金属活动性强弱 .
往 和 的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,有气泡产生.根据上述现象分析,你认为下面结论错误的是
| A. | 滤渣一定有 粉 | B. | 滤渣一定有 粉 |
| C. | 滤液中一定有 | D. | 滤液中一定有 |
某同学设计了探究 、 、 三种金属活动性顺序的实验方案,仅用组内试剂,无法完成的是()
| A. | 、 、 、稀硫酸 | B. | 、 溶液、 溶液 |
| C. | 、 、 溶液 | D. | 、 、稀硫酸、 溶液 |
某合金由铝、铁、铜三种金属组成.现要测定一定质量该合金中铝的质量.设计以下流程并实验。
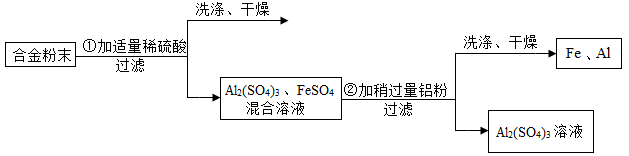
(1)通过以上实验也可验证三种金属的活动性顺序,写出判断依据.
(2)为什么要向合金粉末中加人适量的稀硫酸?
(3)为达到实验目的,需要称量上述流程中哪些物质的质量?如何确定铝的质量?
在已调节至平衡的托盘天平的两盘上各放一只质量相同的烧杯,在两只烧杯里分别放入 溶质质量分数为19.6%的稀硫酸;然后在左盘的烧杯中放入 镁粉,在右盘的烧杯中放入 铝粉,反应后观察天平指针的变化.若只将天平左盘烧杯里的稀硫酸换成 溶质质量分数为19.6%的稀盐酸,其他实验操作不变,反应后也观察天平指针的变化.能够观察到的现象是(酸的挥发忽略不计()
| A. | 两次天平指针最终都在刻度盘中间 |
| B. | 两次天平指针最终都偏向放铝粉的烧杯一边 |
| C. | 两次天平指针最终都偏向放镁粉的烧杯一边 |
| D. | 天平指针第一次最终偏向放镁粉的烧杯一边,第二次偏向放铝粉的烧杯一边 |
向 溶液中加入一定质量 的混合溶液,充分反应后过滤,得到滤渣和浅绿色滤液。下列说法正确的是()
| A. | 滤液中一定含有 |
| B. | 滤液中一定含有 |
| C. | 滤渣中一定含有 |
| D. | 滤渣中一定含有 |
在 、 和 的混合溶液中加人一定量的铁粉,充分反应后过滤.向滤渣中加入稀盐酸,有气泡产生.根据上述现象,下列结论正确的是
| A. | 滤渣中一定有 |
| B. | 滤渣中可能有 |
| C. | 滤液中﹣定有 、 |
| D. | 滤液中可能有 、 |
为了验证铁、铜两种金属活动性大小,某同学设计了如图所示的实验,为了达到试验目的,溶液应该选择
| A.稀硫酸 | B.硫酸镁溶液 | C.氯化钠溶液 | D.植物油 |
用廉价金属回收贵重金属是工业生产中的一道重要程序.某化学兴趣小组的同学在实验室中进行了模拟实验.向含有硝酸铜和硝酸银的废液中加入一定量的铁粉,充分反应后过滤,得到滤液和滤渣.下列说法正确的是()
| A. | 滤液中最多含有三种溶质 |
| B. | 滤液质量比反应前原溶液质量大 |
| C. | 滤液中一定含有硝酸亚铁,滤渣中一定含有银 |
| D. | 若反应后所得滤液呈浅绿色,则滤渣中一定含有铁、铜、银 |
回收利用废金属是解决废金属造成资源浪费和不同程度的环境污染的方法之一.某市一家大型化工厂处理回收含铜废料的生产流程与部分操作如下:

(注:步骤Ⅰ得到的残留物不溶于水和稀硫酸)
请回答下列问题:
(1)黑色固体
的成分是(用化学式表示)。
(2)流程图中操作①的名称是。
(3)写出步骤Ⅲ的一个反应的化学方程式。
(4)通常在步骤Ⅲ必须加入略过量的"铁屑",原因是。
用实验探究铝和铜的金属活动性强弱,若提供的试剂只有:氯化铜溶液、氯化铝溶液、铝、铜和稀盐酸,对此下列说法正确的是
| A. | 最多只能设计一种实验方案 |
| B. | 氯化铜溶液是不可或缺的试剂 |
| C. | 选用两种合适的试剂即可实现实验目的 |
| D. | 氯化铝溶液中加入铜不能探究金属活动性强弱 |
根据下列图示的探究过程,回答下列问题:

(1)操作①的名称.
(2)图中固体中含有的物质(化学式).
(3)写出步骤②发生反应的化学方程式.
将相同状态的铁和镁分别与相同质量分数,足量的稀盐酸反应,产生氢气的质量与反应时间的关系如图所示,下列说法正确的是
| A.铁和镁的质量相同 |
| B.甲是铁、乙是镁 |
| C.铁和镁完全反应所消耗的稀盐酸质量相同 |
| D.反应后溶液的质量均减少 |
根据下面的实验过程和提供的数据,可知样品中碳的质量分数为()

| A. | 44% | B. | 46% | C. | 54% | D. | 64% |