下列图像能正确反映对应变化关系的是
 |
 |
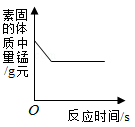 |
 |
| A.一定质量的碳酸钠中不断加入盐酸 |
B.向一定质量的铜锌合金样品中不断加入稀硫酸 |
C.用酒精灯加热一定质量的高锰酸钾固体 |
D.向盛有少量二氧化锰的烧杯中不断加入过氧化氢溶液 |
某化学兴趣小组的学生研究过量的炭粉与Fe2O3在高温条件下反应的气体产物成分。探究过程如下:
(1)提出假设:气体产物全部是CO2。
(2)查阅资料:a.氮气不能与炭粉及Fe2O3反应。
b.高温下可以发生下列反应:2Fe2O3+3C 4Fe+3CO2↑ C+CO2
4Fe+3CO2↑ C+CO2 2CO
2CO
(3)设计方案:将一定量氧化铁在隔绝空气的环境下与过量炭粉充分反应。用实验中实际测得产生气体的质量,与理论计算得到的CO2的质量进行比较。
(4)实验装置:如右图所示。

(5)实验操作:
①称量:反应前Fe2O3的质量3.20 g;炭粉的质量2.00g;玻璃管C的质量48.48 g。反应后玻璃管与残留固体共52.24 g。
②加热前先通一段时间氮气,再夹紧弹簧夹T,点燃酒精喷灯加热。
(6)问题分析:①用酒精喷灯而不用酒精灯的目的是 。
②加热前先通一段时间氮气的目的是 。
③理论计算:若氧化铁与炭粉反应的气体产物全部是CO2,求3.20 g氧化铁完全反应时生成CO2的质量。(写出计算过程)
④根据实验数据计算实验中实际获得气体的质量。(写出计算过程)
(7)结论:原假设 (能、不能)成立,理由是 。
(8)兴趣小组成员小聪想到家里新换的水龙头。他从说明书上了解到该水龙头是铜质镀铬。好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,请你参与。
【作出猜想】
猜想1:Cr>Fe>Cu; 猜想2:Fe>Cu >Cr; 猜想3:你的猜想是 。
【查阅资料】
①铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
②铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
【设计与实验】
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸。
| 实验 |
试管1 |
试管2 |
试管3 |
| 实验 操作 |
 |
 |
 |
| 实验 现象 |
铁片表面产生气泡较慢,溶液变为浅绿色 |
铬片表面产生气泡较快,溶液变成为蓝色 |
铜表面无气泡 |
【结论与解释】
①小聪得到的结论是猜想 正确。
②实验前用砂纸打磨金属片的目的是 。
【知识运用】
将铬片投入FeSO4溶液中,反应 (填“能”或“不能”)进行。若能进行,请你写出化学方程式 。
如图所示,两只U型管中分别加入纯净、等质量的铝粉和铁粉,同时将两端注射器内的液体(等质量、浓度为20%的稀硫酸)快速注入U型管中。
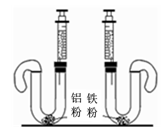
(1)写出铁粉与稀硫酸发生反应的化学方程式 。
(2)反应结束并冷却至室温,发现左端气球膨胀程度明显大于右端,若仅有一只U型管内的硫酸有剩余,则是 (填“左”或“右”)端的U型管。
(3)若将铝粉和稀硫酸换成其他两种化合物(或其溶液),也能观察到气球明显膨胀,这两种物质可能是(写化学式) 。
铁是应用最广泛的金属.新型材料纳米级Fe粉能用作高效催化剂.实验室采用还原法制备纳米级Fe粉,其流程如图所示:
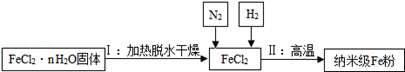
(1)纳米级Fe粉在空气中易自燃.实验中通入N2的目的是 。
(2)写出Ⅱ中H2还原FeCl2得到铁的化学方程式 ,该反应属于基本反应类型中的 反应。
小新拿来一片黄色的金属向同学们炫耀说他拣到了黄金。小宝说他曾在网上看到过,有一种铜锌合金外观和黄金很相似,常被误以为是黄金。于是他与小新开始研究。提出问题:这块黄色金属是换黄金还是铜锌合金?猜想:⑴小新认为是黄金;⑵小宝认为是铜锌合金。查阅资料:合金中的金属保持各自的化学性质,金在高温下不与氧气反应,锌在高温下与氧气反应生成白色固体。
【设计实验】①小新设计的实验是:截取一小片黄色金属放在石棉网上用酒精灯加热;②小宝设计的实验是:截取一小片黄色金属放入硝酸银溶液中。
【现象与结论】
(1)小新在实验中观察到黄色的金属变黑,则他的猜想 。黑色物质是 。
(2)小宝在实验中观察到的现象是 ,写出反应的化学方程式 。
【反思与应用】
(3)假如你的观点和小宝的观点相同,你还可以设计的一个实验是:截取一小片黄色金属放入 溶液中。A.硫酸 B.硫酸镁 C.硫酸锌
(4)你设计的实验中能观察到的现象是 。
现有等质量X,Y的两种金属,分别放入溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图所示(已知X,Y在生成物中化合价均为+2价).则下列说法不正确的是( )
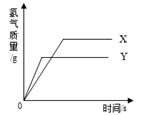
| A.生成氢气的质量:X>Y | B.相对原子质量:X>Y |
| C.金属活动性:Y>X | D.消耗硫酸的质量:X>Y |
A、B、C、D是四种金属单质,A能从B的硝酸盐溶液中置换出B,但A不能与稀盐酸反应。相同条件下,C、D能与稀盐酸反应产生H2,且D比C反应剧烈。则四种金属的活动性由强到弱的顺序是( )
A.A、B、C、D B.B、A、C、D C.D、C、A、B D.D、C、B、A
某校化学实验室废液桶中收集了溶解大量FeSO4、CuSO4的废水,若直接排放到下水道不仅造成重金属污染而且造成浪费。初三(2)班的同学,准备运用刚学到的“常见金属活动性顺序表”结合其他有关化学知识对废水进行处理。
(1)设计除去铜离子,回收硫酸亚铁晶体和铜的实验方案,讨论有关问题:

①废水在加入金属X前需进行过滤,目的是将其中__________性杂质除去。进行过滤的操作所需的仪器有:________、________、________、________(请从下图中选择合适仪器,并用仪器名称填写)。

②金属X是_____________,其加入废水后发生反应的化学方程式为___ ____溶液Y是________利用其除去铜中杂质,有关反应的化学方程式为______________
将等质量、颗粒大小相同的X、Y、Z三种金属分别投入到相同浓度的足量的稀硫酸中,生成氢气的质量与时间的关系如图所示。已知它们在化合物中均显+2价,则下列说法不正确的是( )
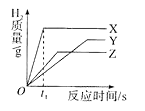
| A.在时间为t1时,生成氢气的质量为:X>Z>Y |
| B.金属活动性:X>Z>Y |
| C.相对原子质量:X>Y>Z |
| D.X、Y和Z可能分别是常见金属中的Mg、Fe、Zn |
验证金属Fe Cu Ag的活动性强弱,下列方案不能达到目的是
| A.Fe CuSO4溶液 Ag |
| B.FeSO4溶液 Cu AgNO3溶液 |
| C.Fe Cu AgNO3溶液稀盐酸 |
| D.FeSO4溶液 Cu Ag |
氯化铁溶液能与铜反应生成可溶性的氯化铜和氯化亚铁,工业上常用此原理生产印刷线路板。以下是印刷线路板的生产及废液的处理过程:
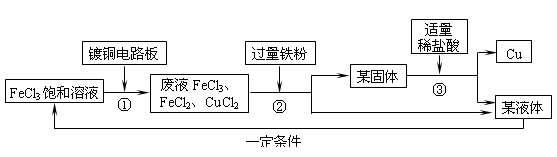
请回答下列问题:
(1)步骤②③中实验操作的名称是 。
步骤②实验操作前发生了两个反应:2FeCl3+Fe = 3FeCl2和 ,
(2)步骤③中适量稀盐酸的标志是 ;
发生反应的化学方程式是 。
(3)该流程中可以循环、回收利用的物质是 。
向一定量的AgNO3与Cu(NO3)2的混合溶液中加入一定量的锌粉,充分反应后过滤。分析判断下列说法正确的是
| A.滤渣中一定有Ag,可能有Zn和Cu |
| B.滤渣中一定有Cu、Ag,可能有Zn |
| C.滤液中只有Zn(NO3)2 |
| D.滤液中一定有Zn(NO3)2,可能有Cu(NO3)2和AgNO3 |
对物质的性质进行比较归纳,有利于更好的学习化学。下列对物质性质的归纳中,正确的是
A.H2、O2、CH4都具有可燃性
B.H2、C、CO都能和CuO发生置换反应
C.石墨、木炭、活性炭都具有吸附性
D.Fe、Al、Cu都能和AgNO3溶液发生置换反应
下列4个坐标图分别表示4个实验过程中某些质量的变化,其中不正确的是
| A.向一定量过氧化氢溶液中加入少量二氧化锰 |
| B.向相同质量与浓度的稀盐酸分别加入足量的铁粉和锌粉 |
| C.向相同质量的铁粉和锌粉中分别加入足量稀盐酸 |
| D.一氧化碳与一定量氧化铁在高温条件下完全反应 |