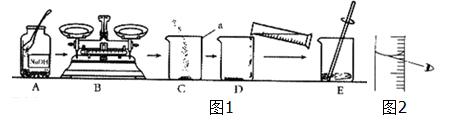
下图是小华配制100g溶质质量分数为7.5%的NaCl溶液的实验操作示意图:

(1)上图中的玻璃仪器分别是广口瓶、量筒、 和玻璃棒,其中玻璃棒在此操作中的作用是 。
(2)指出图②中的一处错误操作 。
(3)通过计算确定需要水的质量是 g,配制时应选择 (填10、50或100)mL的量筒量取所需要的水。
(4)下列错误操作可能导致溶液溶质的质量分数小于7.5%的是____________(填序号)
| A.②操作中食盐与砝码放置颠倒; |
| B.①操作中有固体洒落; |
| C.⑤操作中有水溅出; |
| D.读取量筒内液体体积于视线过低; |
E.装瓶存放操作中溶液洒落。
(5)该同学在称量氯化钠药品前天平的指针偏左,则所配制的溶液的质量分数 (填“偏大”“偏小”“不受影响”)
在 100 g溶质的质量分数为5%的食盐溶液中加入5 g食盐再加100 g水,完全溶解后,溶液的质量为 ,溶质的质量为 ,溶质的质量分数为
如图是甲、乙、丙(均不含结晶水)三种物质的溶解度曲线,请据图回答下列问题.

(1)在40℃时,甲、乙、丙三种物质的溶解度由大到小的关系是 (物质间用“>”连接);
(2)将30℃的三种物质的饱和溶液冷却到20℃后,所得溶液中溶质的质量分数由小到大的关系是:
(物质间用“<”连接);
(3)现有一定质量的B溶液,将该溶液在50℃下恒温蒸发10克水后析出了2克B晶体,再恒温蒸发5克水后,又析出了2克B晶体,则B物质在50℃时的溶解度是: .
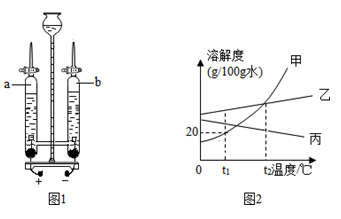
现有一瓶混有少量氯化钾的硝酸钾粉末,请参照如图KCl和KNO3的溶解度曲线,回答下列问题:

(1)t℃时KCl的溶解度 KNO3的溶解度(填“大于”“小于”或“等于”).
(2)60℃时 g KNO3溶于50g水中恰好形成饱和溶液.
(3)设计实验方案提纯KNO3.
实验方案:在提纯混有少量氯化钾的硝酸钾时,先在较高温下将混合物溶于水中形成热的浓溶液,然后 ,即有大量硝酸钾晶体析出,再进行 操作,即可分离得到较为纯净的硝酸钾晶体.
淮安市某盐化厂生产的碳酸钠粗产品中含有少量氯化钠.碳酸钠和氯化钠的溶解度与温度的关系如图所示,回答下列问题:

(1)t1℃时碳酸钠与氯化钠中溶解度较大的物质是 .
(2)t1℃时碳酸钠溶液升温至t2℃,所得溶液的溶质质量分数 .(填“变大”、“变小”或“不变”).
(3)除去碳酸钠中混有少量氯化钠的方法是 .
如图为甲、乙两种固体物质在水中的溶解度曲线,据此回答下列问题:

(1)在40℃时甲、乙两种固体物质的溶解度 (填“相同”或“不同”).
(2)两种物质中 物质的溶解度随温度的升高而降低.(填“甲”或“乙”)
(3)若要从甲的60℃的饱和溶液中得到甲(固态),应该采用 的方法.(填序号)
A.升高温度到70℃
B.降低温度
C.加入一定量的水.
如图是
,
,
三种固体物质的溶解度曲线,请回答下列问题:

(1)
点的含义是;
(2)若
点混有少量
时,可采用的方法提纯
;
(3)
℃时,能不能配制溶质的质量分数为40%的
溶液?(填"能"或"不能");
(4)
℃时,将
,
,
三种固体物质各30
加入到100
水中,充分溶解,形成不饱和溶液的是;
(5)将
℃时
,
,
三种固体物质的饱和溶液升温到
℃,其溶质的质量分数由大到小的顺序是。
在实验室里可用以下两种方法配制质量分数为10%的
溶液

(1)方法一中配制100g 10%的
溶液,需要
固体g。
(2)方法二中用量筒量取25%的
溶液时仰视读数,其他操作均正确,所配溶液中溶质的质量分数10%(选填"大于"、"小于"或"等于");
(3)方法一中的"溶解"和方法二中的"混匀",都要用到的仪器是。
探究学习小组在制作"叶脉书签"时,需要将树叶放在质量分数为
的氢氧化钠溶液中煮沸,如图1所示为该小组配制
的氢氧化钠溶液的操作过程:
(1)图1中仪器
的名称是,写出该仪器的另一种用途;
(2)操作
中,必须将氢氧化钠固体放在里,并置于托盘天平盘(填"左"或"右")进行称量;
(3)操作
中,用量筒量取所需体积的蒸馏水时还用到(填写仪器名称),某同学在读取量筒读数时的视线如图2所示,若其他操作正确,则会造成所配制氢氧化钠溶液的质量分数(填写"偏大"、"偏小"或"无影响").
(4)如果不慎将氢氧化钠溶液沾到皮肤上,要先用大量水冲洗,再涂上.
(5)制作"叶脉书签"结束后,刘强同学想继续测定废液的酸碱度,下列用品不需要的是(填写字母标号)
| A. |
玻璃棒 |
B. |
pH试纸 |
C. |
酚酞试液 |
D. |
白瓷板(或玻璃片) |
水在生活、生产和化学实验中起着十分重要的作用.
(1)水的净化.向浑浊的天然水中加入明矾,静置一段时间后,取上层液体过滤,得到略带颜色的液体。实验中加入明矾的作用是,过滤操作中用到的玻璃仪器有烧杯、玻璃棒、(填仪器名称),其中玻璃棒的作用是。
(2)水的组成.用如图1实验装置可以证明水的组成,检验
处气体的方法是。
(3)水的用途.水是常用的溶剂.如图2为甲、乙、丙三种不含结晶水的固体物质的溶解度曲线。
①
,若将
甲物质放入
水中充分溶解得到g溶液。
②若固体乙中混有少量固体甲,提纯乙的方法是:溶解、过滤。
③将
时丙的饱和溶液降温到
时,丙溶液为(填"饱和"或"不饱和")溶液,溶质质量分数(填"变大"、"变小"或"不变")。
如图是配制溶质质量分数为10%的
溶液的实验操作示意图:
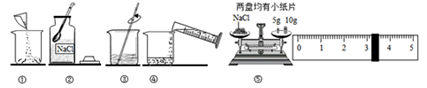
(1)用图中序号表示配制溶液的正确操作顺序;
(2)图②中用来取用
的仪器是;
(3)称量
时,天平平衡后的状态如图⑤所示,游码标尺示位置见图,则称取的
质量为g;
(4)
称量完毕放回砝码时,发现10g的砝码有缺损,若其他操作步骤正确,则所配制溶液的质量分数(填"大于"、"小于"或"等于")10%。
配制50g质量分数为10%的氢氧化钠溶液,下列失误会导致所配溶液溶质质量分数偏大的是()
| A. | 装瓶时,有溶液洒出 |
| B. | 将量筒中的水倒入烧杯时有水溅出 |
| C. | 溶解时未用玻璃棒搅拌 |
| D. |
根据下列溶解度表和溶解度曲线回答问题.
| 温度/℃ |
0 |
20 |
40 |
60 |
| 溶解度/ | 13.3 |
31.6 |
63.9 |
110 |
(1)图中表示硝酸钾溶液溶解度曲线的是(填"甲"、"乙"或"丙")。

(2)60℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是。
(3)60℃时,取甲、乙、丙各40
分别加入100
水中充分溶解后,能形成饱和溶液的是。
(4)将20℃的
饱和溶液升温到60℃(不考虑水分蒸发),其溶质的质量分数(填"变大"、"变小"或"不变")。
实验室用已配置好的质量分数为6%的氯化钠溶液(密度约为
),配制50g质量分数为3%的氯化钠溶液.
(1)配制步骤为:计算、、混匀。
(2)需要6%的氯化钠溶液mL。(结果取整数)
(3)某同学在量取6%的氯化钠溶液体积时俯视读数,则实际配制溶液的溶质质量分数将(填"偏大"、"偏小"或"不变").
如图是氯化钠和硫酸钠的溶解度曲线,看图后回答问题:

(1)的溶解度收温度影响变化不大。
(2)温度不变时,若将氯化钠的不饱和溶液变为饱和溶液可采取的方法是。(填一种即可)
(3)40℃时,将30
硫酸钠固体加入到50
水中充分溶解,所得溶液的质量是。
(4)用降温结晶的方法提纯含少量杂质氯化钠的硫酸钠,最佳的温度范围是℃以下,理由是。