泡菜具有独特的风味,适合制作泡菜的食盐水浓度是4%。在配制4%的食盐水2000g时,下列做法:①用80g食盐和2000g水配制溶液;②称量食盐时(1克以下用游码),食盐放在右盘的纸上;③量水的体积时,俯视量筒;④溶解食盐的烧杯内壁是潮湿的 ;其单一错误会导致溶液浓度偏小的是 。
下图是某同学配制50g质量分数为5%的氯化钠溶液的全过程
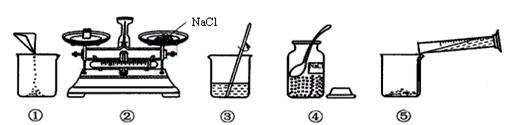
(1)该实验的正确操作顺序是 ;
(2)配制使用的玻璃仪器分别是 、玻璃棒、胶头滴管、 。
(3)若按图示操作,所称取的氯化钠实际质量为 g(1g以下用游码),量取水最好选择 (填序号A.10ml B.50ml C.100ml)的量筒。
配制150g16%的氯化钠溶液需氯化钠 克,水 ml;若用24% 的氯化钠溶液配置,需24%的氯化钠溶液 克。
(1)配制10%的盐酸的步骤有:①稀释 ②计算 ③装瓶并贴标签 ④量取浓盐酸和水.其正确的顺序为 (填序号).
(2)配制氢氧化钠溶液时,需要的玻璃仪器有量筒、烧杯、滴管及 。
(3)用配得的氢氧化钠溶液与待测的硫酸溶液反应,实验过程中
溶液的pH变化曲线如图所示:
a点对应的溶液呈 (填“酸性”、“碱性”或“中性”);
b点对应的溶液中的溶质为 (写化学式).
下面表格中列出了NH4Cl在不同温度下的溶解度:
| 温度/℃ |
0 |
20 |
40 |
60 |
| 溶解度/g |
29.4 |
37.2 |
45.8 |
55.2 |
(1)由上表可推出NH4Cl的溶解度随温度的变化规律是 ;
(2)在20 ℃时,向100 g水中加入50 g NH4Cl,形成 (填“饱和”或“不饱和”)溶液,将其温度升高到60 ℃时,形成的溶液中溶质与溶剂的质量比为 。
如图是a、b两种固体物质的溶解度曲线。试回答:
(1)t ℃时,两物质溶解度大小关系为a b(填“>”“<”或“=”);
(2)当a中含有少量b时,可以用 法提纯a;
(3)在 ℃时,a、b的溶解度相等,此温度下所得溶液中溶质的质量分数最大为 。