将200g溶质质量分数为10%的蔗糖溶液,蒸发水变成溶质质量分数为20%的蔗糖溶液,需蒸发水的质量为
| A.90g | B.150g | C.100g | D.80g |
对“10%的食盐水”含义解释不合理的是
| A.100g食盐水中溶解了10g氯化钠 |
| B.将氯化钠与水按10:90的质量比配成的溶液 |
| C.100g水中溶解了10g氯化钠 |
| D.将20g氯化钠溶解在180g水中所得的溶液 |
下列化学实验中能达到预期实验结果的是
| A.借助托盘天平和其他手段测定铜锌合金中锌的质量分数为36.25% |
| B.用pH试纸测定某未知溶液的pH为5.5 |
| C.20℃时,配制2%的氢氧化钙溶液 |
| D.将100g 10%的稀盐酸加热蒸发掉50g水,使得稀盐酸溶质质量分数变成20% |
下列有关“配置50g溶质质量分数为6%的氯化钠溶液”的操作错误的是
| A.使用托盘天平前,要先取下支撑托盘的垫圈,再调节天平平衡 |
| B.称取氯化钠前,要在天平两端的托盘上分别放质量相同的纸片 |
| C.移动游码使其右侧对齐3g的刻度线,然后将氯化钠加到天平的左盘上 |
| D.取用规格为50ml的量筒量取47ml水,快到所需刻度时改用胶头滴管定容 |
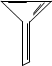
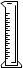
用氯化钠固体配制50g质量分数为5%氯化钠溶液,下列仪器中需要用到的是
| ① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
 |
 |
 |
 |
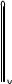 |
 |
 |
A.②④⑥⑦ B.①④⑤⑥
C.①③⑤⑦ D.①③④⑥
如图表示M、N两种固体物质的溶解度曲线,有关图示信息的描述正确的是
| A.30℃时M的溶解度小于N的溶解度 |
| B.M、N都属于微溶物质 |
| C.P点表示t℃时M、N两种物质的溶解度相等 |
| D.阴影部分属于两种物质的不饱和区域 |
配制50g10%的食盐溶液时,有以下操作:①溶解 ②称量 ③计算 ④量取,其中正确的操作顺序是
| A.③②④① | B.①②③④ | C.③②①④ | D.②③④① |
60℃时,A、B两种物质的溶解度A<B。分别取60℃时等质量的A、B两种物质的饱和溶液,降温至30℃,析出A、B晶体的质量分别为m g和n g(A、B均不含结晶水)。下列判断正确的是
A.30℃时,A、B两种物质的溶解度一定为A<B
B.30℃时,A、B饱和溶液中溶质的质量分数一定为A=B
C.30℃时,若溶解度A>B,则晶体质量一定为m<n
D.30℃时,若溶解度A<B,则晶体质量一定为m>n
甲、乙两种物质的溶解度曲线如图所示。叙述正确的是
| A.依据溶解度曲线可判断,甲的溶解度比乙的大 |
| B.将甲、乙的饱和溶液从t2℃降到t1℃,析出甲的质量大 |
| C.将t2℃时甲的饱和溶液变为不饱和溶液,可采取降温方法 |
| D.t1℃时,甲和乙的饱和溶液各100 g,其溶质的质量一定相等 |
将20℃时某KNO3溶液均分为两份,第一份恒温蒸发掉10克水,析出a克晶体;第二份恒温蒸发掉20克水,析出晶体b克。则a与b的关系正确的是
| A.2a=b | B.2a≤b | C.2a≥b | D.2a<b |
用氯化钠固体配制一定质量分数的氯化钠溶液,必须使用的一组仪器是
| A.天平、烧杯、量筒、玻璃棒、药匙 |
| B.天平、烧杯、量筒、铁架台、药匙 |
| C.天平、烧杯、漏斗、蒸发皿、玻璃棒 |
| D.天平、集气瓶、漏斗、蒸发皿、玻璃棒 |
实验室配制100g10%的氯化钠溶液,有关实验操作不正确的是 ()
| A. | 用托盘天平称取10.0g氯化钠 |
| B. | 用量筒量取90.0mL 的水 |
| C. | 将称取的氯化钠倒入量筒中溶解 |
| D. | 将配制的溶液装入试剂瓶中,贴上标签 |
甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图
所示,下列说法中正确的是
| A.20℃时,溶解度:甲>乙>丙 |
| B.50℃时,在100g水中放入33.3g乙,充分搅拌后所得溶液中溶质的质量分数为33.3% |
| C.若要从甲溶液(含有少量乙)中提取甲,最好采用蒸发结晶的方法 |
| D.50℃时甲、乙、丙的饱和溶液中溶质的质量分数:甲>乙>丙 |
甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是
| A.20℃时,甲溶液中溶质质量一定小于乙溶液 |
| B.20℃时,可配制溶质质量分数为30%的乙溶液 |
| C.20℃时,100 g水中加入20 g甲可得到饱和溶液 |
| D.50℃时,100 g水中加入20 g乙并降温至20℃, |
溶液由不饱和变饱和
要配制100g溶质质量分数为10%的氯化钠溶液,下列操作正确的是
| A.将10g氯化钠固体直接放在天平的托盘上称量 |
| B.用于溶解氯化钠的烧杯内壁有大量水滴 |
| C.为加快固体溶解,用玻璃棒边搅拌边碾压氯化钠晶体 |
| D.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签 |