实验室配制50g质量分数为6%的氯化钠溶液,整个配制过程如图所示,其正确的操作顺序是()
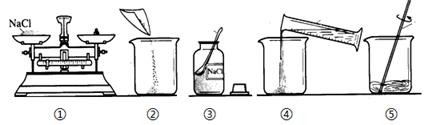
| A. | ③①②④⑤ | B. | ①③④②⑤ | C. | ③①④②⑤ | D. | ①④③②⑤ |
用下列实验操作可完成两个实验。甲实验为粗盐中难溶性杂质的去除,乙实验为配制溶质质量分数为10%的氯化钠溶液。下列说法中,正确的是
| A.甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发 |
| B.甲实验各步操作中,玻璃棒的作用都是相同的 |
| C.乙实验若按照②③①的步骤进行操作, 则配制的溶液浓度偏大(水的密度为1g/cm3) |
| D.乙实验中,若①所用的烧杯内壁沾有水,对配制的溶液浓度无影响 |
用固体氯化钠配制50g溶质质量分数为6%的氯化钠溶液。下列有关说法正确的是
| A.选择的玻璃仪器有烧杯、50mL量筒、玻璃棒、胶头滴管、试剂瓶 |
| B.将氯化钠直接放在托盘天平左盘上称量为3.0g |
| C.用内壁附有水珠的烧杯配制溶液 |
| D.转移已配制好的溶液时,有少量溶液溅出会使溶液中氯化钠的质量分数减小 |
下图是恒温下模拟海水晒盐过程的示意图,与丙烧杯溶液的溶质质量分数一定相同的是()

| A. | 甲 | B. | 甲和乙 | C. | 乙和丁 | D. | 丁 |
下列有关溶液的叙述,正确的是
| A.某物质的饱和溶液变为不饱和溶液,溶质的质量分数一定变小 |
| B.在一定温度下,同一物质的饱和溶液一定比不饱和溶液溶质的质量分数大 |
| C.任何物质的饱和溶液,当温度降低时一定会析出溶质 |
| D.饱和溶液析出晶体后,剩余溶液中溶质的质量分数一定变小 |
下列有关溶液的说法中,正确的是
| A.不饱和溶液转化为饱和溶液,溶液中溶质的质量分数一定增大 |
| B.将5g某物质完全溶解于95 g水中,所得溶液中溶质的质量分数一定是5% |
| C.饱和溶液不一定是浓溶液,不饱和溶液一定是稀溶液 |
| D.将一定质量某物质的饱和溶液降温析出晶体后,所得溶液中溶质的质量一定减小 |
的部分溶解度数值如表,下列说法正确的是
| 温度 |
溶解度(g) |
| 20 | 34 |
| 30 | 37 |
| A. |
常温下, 微溶于水 |
| B. |
20 时,100g饱和溶液含有34g溶质 |
| C. |
将30 的饱和 溶液降温至20 ,会有 晶体析出 |
| D. |
相同质量的水中加入不同质量的 ,所得溶液的溶质质量分数一定不同 |
如图所示,甲、乙是两种物质的溶解度曲线,下列叙述正确的是
| A.40℃时,甲、乙两种物质的溶液中溶质的质量分数相等 |
| B.40℃时,甲、乙两种物质的溶解度相等 |
| C.采用降温的方法可将乙的不饱和溶液转化为饱和溶液 |
| D.60℃时,在100 g甲的饱和溶液中,含溶质甲60g |
海水淡化可采用膜分离技术。如图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中其他各种离子不能通过淡化膜,从而得到淡水。对加压后右侧海水成分变化分析正确的是
| A.溶质质量增加 | B.溶剂质量减少 |
| C.溶液质量不变 | D.溶质质量分数减少 |
将含泥沙的粗盐提纯,并用制得的精盐配制80g10%的食盐溶液。下列说法错误的是
| A.过滤时搅拌漏斗中的液体,可以加快过滤的速度 |
| B.蒸发滤液时,不断用玻璃棒搅拌,防止液体溅出 |
| C.配制溶液的步骤是:计算、称量、溶解 |
| D.配制时需用的主要仪器有:天平、药匙、量筒、胶头滴管、烧杯、玻璃棒 |
下列是小明"配制50g溶质质量分数为20%的氯化钠溶液"的实验过程正确的是()
| A. | 计算需要氯化钠10g、水40g |
| B. | 将氯化钠放到托盘天平右盘称量 |
| C. | 将氯化钠放在量筒中溶解 |
| D. | 将配制好的溶液转移一半后,小明认为剩余溶液溶质质量分数为10% |
如右图所示,20℃时100g硫酸铜饱和溶液中,分别加入下列物质后,相关分析错误的是
| A.溶质质量:Ⅰ=Ⅲ>Ⅱ | B.溶剂质量:Ⅰ>Ⅲ>Ⅱ |
| C.溶液质量:Ⅰ>Ⅱ=Ⅲ | D.溶质质量分数:Ⅰ<Ⅱ=Ⅲ |
白酒的 “度数”指的是白酒中酒精的含量。这里的含量不是指质量分数,而是体积分数。例如,52度(520)的白酒表示100ml白酒中含有52ml酒精(常温时)。蒸馏水密度为1g/cm3,酒精密度为0.8g/cm3,若为40度(400)的白酒溶液中溶质的质量分数约为
| A.40% | B.60% | C.34.8% | D.无法判断 |