江苏省张家港市九年级上学期期末化学试卷
节约用水、防止水体污染应成为我们的自觉行为。下列有关叙述错误的是
| A.生活中使用无磷洗衣粉,以防止水体污染 |
| B.农业生产中改变灌溉方式,变漫灌为喷灌或滴灌,以节约用水 |
| C.遵循“先净化,后排放”的原则来处理城市生活污水、工业生产废水 |
| D.采用燃烧氢气的方式生产水,以补充城市饮用水资源的不足 |
氧气是空气的主要成分之一。有关氧气的说法错误的是
| A.空气中的氧气主要来自于植物的光合作用 |
| B.氧气可以支持燃烧,说明氧气具有可燃性 |
| C.鱼类能在水中生活,证明水中溶有氧气 |
| D.空气中的氧气可以和很多物质发生化学反应 |
翡翠是人们喜爱的一种装饰品,翡翠的主要成分是硬玉,其化学式为NaAl(SiO3)2,其中Si元素的化合价是
| A.+1 | B.+2 | C.+3 | D.+4 |
根据化学方程式不能获得的信息是
| A.化学反应中的反应物和生成物 |
| B.参加反应的各反应物、生成物之间的质量比 |
| C.化学反应速率的快慢程度 |
| D.化学反应发生所需要的条件 |
下列有关溶液的说法正确的是
| A.溶液都是无色透明的液体 | B.溶液中各部分的性质相同 |
| C.溶液中各部分的密度不同 | D.溶液中只能有一种溶质 |
-下列关于分子和原子的说法中错误的是
| A.分子间有间隔 | B.分子在化学变化中可以再分 |
| C.原子不能直接构成物质 | D.分子在不停地运动 |
下列说法中正确的是
| A.合金中一定不含有非金属 |
| B.生铁可以完全溶解在足量的稀盐酸中 |
| C.不锈钢是永不生锈的钢铁 |
| D.高炉炼铁的废气必须要经过处理才能排放到大气中 |
下列有关物质燃烧现象的叙述中,正确的是
| A.铁丝在氧气中燃烧:火星四射,生成红色固体 |
| B.木炭在空气中燃烧:发出白光,生成一种刺激性气味的气体 |
| C.镁条在空气中燃烧:发出耀眼的白光,生成一种白色固体 |
| D.红磷在空气中燃烧:发出白光,生成大量白色烟雾 |
下列解释错误的是
| A.木材着火用水浇灭——降低木材的着火点 |
| B.扑灭森林火灾时开辟隔离带——清除和隔离可燃物 |
| C.用扇子扇煤炉,越扇越旺——供给燃烧所需的足够氧气 |
| D.炒菜时油锅着火,可用锅盖盖灭——隔绝空气 |
关于二氧化碳的说法正确的是
| A.二氧化碳不能供给呼吸,也不能作为植物养料 |
| B.实验室常用大理石和稀硫酸反应来制取二氧化碳 |
| C.将二氧化碳气体通入紫色石蕊试液中,再加热溶液,溶液的颜色变化过程为紫色→红色→紫色 |
| D.若二氧化碳在空气中含量过高,则会引发酸雨 |
关于铁、铝、铜的说法正确的是
| A.都是银白色的金属 |
| B.都能与稀硫酸反应 |
| C.都能与氧气反应 |
| D.人类利用三种金属的年代先后顺序是铁、铜、铝 |
用固体氯化钠配制50g溶质质量分数为6%的氯化钠溶液。下列有关说法正确的是
| A.选择的玻璃仪器有烧杯、50mL量筒、玻璃棒、胶头滴管、试剂瓶 |
| B.将氯化钠直接放在托盘天平左盘上称量为3.0g |
| C.用内壁附有水珠的烧杯配制溶液 |
| D.转移已配制好的溶液时,有少量溶液溅出会使溶液中氯化钠的质量分数减小 |
下列关于化学反应与能量变化的叙述错误的是
| A.在化学反应中只有燃烧才能放出热量 |
| B.物质的缓慢氧化均放出热量 |
| C.物质发生化学反应的同时伴随着能量变化 |
| D.人们使用化石燃料(如煤、石油和天然气等)是利用它燃烧产生的热量 |
葡萄中含有丰富的白黎芦醇(C14H12O3),它具有抗癌性能,能抑制癌细胞的增生。下列有关白黎芦醇的说法正确的是
| A.它的相对分子质量为216 |
| B.它由碳、氢、氧三种元素组成 |
| C.该物质中,碳、氢、氧三种元素的质量比为14:12:3 |
| D.它是由14个碳原子、12个氢原子和3个氧原子构成的 |
下列实验方法错误的是
| A.用稀硫酸除去铁粉中混有的少量铜粉 |
| B.用冷却结晶的方法除去硝酸钾溶液中的少量氯化钠 |
| C.用水除去二氧化锰中混有的氯化钾 |
| D.用带火星的木条鉴别氧气和二氧化碳 |
下列实验操作符合规范要求的是
| A.“高锰酸钾制氧气”实验中,收集好气体后应先将导管移出水槽再停止加热 |
| B.“粗盐的提纯”实验中,过滤时将悬浊液直接倒入漏斗里 |
| C.制备气体时,先装药品,后检查装置气密性 |
| D.用托盘天平称量物质时,先加质量小的砝码,再加质量大的砝码,最后移动游码 |
类推是化学学习中常用的方法。以下类推结果正确的是
| A.氧化物中都含有氧元素,所以含有氧元素的化合物都是氧化物 |
| B.溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小, |
| C.点燃H2与O2的混合气可能发生爆炸,则点燃天然气(主要成分是CH4)与O2的混合气也可能发生爆炸 |
| D.某物质在空气中燃烧生成CO2和水,则该物质中一定含有碳、氢、氧三种元素 |
下列有关仪器用途说法不恰当的是
| A.温度计代替玻璃棒用于搅拌 |
| B.烧杯用于较多量试剂的反应容器 |
| C.试管用于装配气体发生装置 |
| D.胶头滴管用于吸取或滴加少量液体 |
下图是“一氧化碳与氧化铁反应”的部分实验装置,关于该实验说法正确的是
| A.充分反应后,玻璃管中的固体物质能被磁铁吸引 |
| B.在实验过程中,黑色的粉末会逐渐变成红色 |
C.该实验的反应原理为FeO+CO Fe+CO2 Fe+CO2 |
| D.在实验过程中,产生的尾气是二氧化碳 |
下图是探究铁制品锈蚀条件时做的五个实验(铁钉在不同环境中),实验一段时间后,得出的结论错误的是
| A.甲、乙、戊中铁钉生锈快慢的顺序为乙>甲>戊 |
| B.丙中的铁钉不生锈 |
| C.铁生锈的主要条件是与空气、水直接接触 |
| D.丁中铁钉生锈最严重 |
下列化学实验与数据记录正确的是
| A.用10mL量筒量取7.25mL酒精 |
| B.用托盘天平称取10.0g水 |
| C.电解水得到氢气和氧气的体积比为1:2 |
D.用上图所示装置进行实验(红磷过量),进入集气瓶中的水的体积约占集气瓶容积的 |
通过下图所示实验得出的结论中正确的是
①既说明甲烷具有可燃性,又说明甲烷中含有碳、氢两种元素
②既说明二氧化碳密度比空气大,又说明二氧化碳不燃烧也不支持燃烧
③既可探究可燃物的燃烧条件,又说明白磷的着火点比红磷低
| A.①② | B.①③ | C.②③ | D.①②③ |
实验室需配制10%的稀硫酸200g,需要溶质质量分数为98%,密度为1.84g.mL-1的浓硫酸的体积为
| A.10.7mL | B.10.9mL | C.11.1mL | D.20.4mL |
下表列出了20℃时KNO3溶解实验一组数据:
下列叙述中错误的是
| A.①②所得溶液是不饱和溶液 |
| B.③中m=13.2 |
| C.④所得溶液的质量分数为32% |
| D.20℃时KNO3的溶解度为32g |
写出下列反应的化学方程式。
(1)碳不完全燃烧: 。
(2)用稀硫酸除铁表面的铁锈: 。
(3)实验室制取二氧化碳气体: 。
(4)在硫酸铜溶液中滴加氢氧化钠溶液: 。
(5)将二氧化碳气体通入澄清石灰水中: 。
某品牌酱油每100mL中铁营养剂的标准添加量是200mg,铁营养剂中铁元素质量分数为12.5%。
(1)酱油中加铁营养剂的目的是预防
(2)成年人每天需要铁元素量为1.1mg~2mg,若全从酱油中获取铁元素,则每人每天酱油食用量不得
超过 mL。
(3)硫酸亚铁也是一种补铁剂,试计算一瓶448mL该品牌酱油中所含的铁元素相当于 硫酸亚铁中所含的铁元素的质量。
通过化学学习,我们已经掌握了实验室制取气体的一般规律。下面是实验室提供的一些实验装置:
请结合图中提供的仪器回答问题。
(1)写出图中标号a的仪器名称
(2)实验室可用高锰酸钾、双氧水来制备氧气,应选用的实验装置对应为 ,发生反应的化学方程式分别是 、 ,在以上选用的装置中有一种需作改进,改进的方法是 。
(3)通过查阅资料得知:①氨气(NH3)是一种密度比空气小且极易溶于水的气体,其水溶液称为氨水;②氨气在加热条件下能与氧化铜反应生成铜、水和空气中含量最多的气体。
①若用加热氯化铵和氢氧化钙的固体混合物制取氨气,则应选择的反应发生装置和收集装置对应为 。
②请写出氨气和氧化铜在加热条件下反应的化学方程式: 。
某小组同学在实验室中欲从含有硫酸亚铁、硫酸铜的废液中回收金属铜,过程如下:
(1)操作I、操作Ⅱ的名称是 ,该操作中玻璃棒的作用是 。
(2)固体X中含有 。
(3)溶液B中溶质的化学式为 。
(14分)水在实验室和日常生活中有很多用途。
I、溶液是日常生活中的常见物质,水是最常用的溶剂。
20℃时,将等质量的甲、乙两种固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度曲线如图3。请结合图示回答下列问题: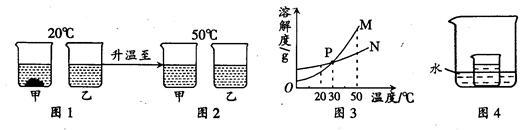
(1)图1中一定为饱和溶液的是
(2)图3中表示乙的溶解度曲线是 ;P点表示的含义是 。
(3)在图4所示的实验中,小烧杯内盛放的是20℃时甲物质的饱和溶液。某同学要使小烧杯内有固体析出时,他应向大烧杯的水中加入下列物质中的 (填字母)。
A.氧化钙 B.氯化钠 C.氢氧化钠 D.硝酸铵
Ⅱ、水在工业生产中也很重要。
以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。电解饱和食盐水可以得到多种化工产品,主要过程如下: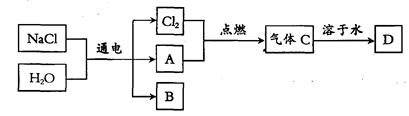
[资料卡:石灰水中的溶质是一种碱——Ca(OH)2]
(4)已知气体A是密度最小的气体,B是一种碱,D是一种酸。写出金属铝和酸D反应生成气体A的化学方程式: 。
(5)B的化学式为 。
(6)工业上电解食盐水是在立式隔膜电解槽中进行,产生的Cl2和气体A在两处逸出并分别收集、储存。
①已知20℃,S(NaCl)=36g,则室温下,68 kg饱和食盐水中溶质的质量为 。
②电解一段时间,当收集到氯气的质量为0.71 kg时,列式计算生成的B的质量 。
③0.71 kg氯气和A完全反应生成气体C,溶于一定量的水中形成酸D。若酸D中的溶质质量分数为36.5%,则其中水的质量为 。

 不能确定的是
不能确定的是
 粤公网安备 44130202000953号
粤公网安备 44130202000953号