实验室要配制100 g溶质质量分数为3% 的氯化钠溶液。
(1)步骤:①计算:需要氯化钠的质量 g;②称量固体氯化钠;③量取一定体积的水;④ ;⑤装瓶;⑥贴标签。
(2)以下操作正确的是 (填序号)。
实验室配制50 g 16%的氯化钠溶液的操作如下图所示。①中玻璃棒的作用是 ;称量的食盐质量为 ;该实验的正确操作顺序为 (填序号)。
配制100 g 5%的氯化钠溶液,主要步骤是:计算、称量、量取、溶解、装瓶贴标签。
(1)溶解过程中用到的仪器有 。
(2)实际配制的溶液中溶质的质量分数小于5%,其原因可能有 。
| A.氯化钠固体不纯 | B.固体倒入烧杯时洒落 |
| C.配制时烧杯不干燥 | D.装瓶时有液体溅出 |
| 序号 物质 |
① |
② |
③ |
④ |
| 液体 |
|
|
|
|
| 固体 |
|
|
|
|
溶液在生命活动中起着十分重要的作用。
(1)下列物质与水充分混合后,能形成溶液的是__________。
| A.花生油 | B.葡萄糖 | C.面粉 | D.冰 |
(2)医疗上常用0.9%的氯化钠溶液作为生理盐水,生理盐水中的溶质为__________。一袋100mL(密度约为1g/mL)的生理盐水,所含溶质的质量是__________。
(3分)下图表示某物质在水(a)和酒精(b)中的溶解度曲线。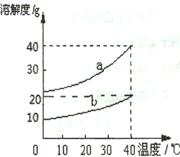
(1)40℃时,该物质在酒精中的溶解度为 。
(2)影响该物质在水和酒精中的溶解度的主要因素是 。
(3)40℃时,其饱和水溶液的溶质质量分数为: 40%(填“>”、“=”或“<”)。
在实验课上,老师要同学们配制15%的氯化钠溶液50 g。
(1)计算:配制15%的氯化钠溶液50 g,需氯化钠的质量为 g。
(2)甲同学按下图所示步骤依次操作。
其错误的操作步骤有 (填字母序号);B中仪器名称为 ;E中玻璃棒的作用是 。
(3)乙同学在将称量好的氯化钠倒入烧杯中时,不小心有一部分氯化钠固体撒出,则其所配溶液溶质质量分数与15%相比 (填“偏低”、“偏高”、或“相等”)。
及时对化学知识进行归纳总结是重要的学习方法,下列的有关结论正确的是
| A.氢氧化钠溶液能使酚酞试液变红色,则能使酚酞试液变红色的一定是碱溶液 |
| B.其它条件不变时,只要某溶液降温析出晶体,则该溶液的溶质质量分数一定减小 |
| C.硫酸溶液中加入氯化钡溶液产生白色沉淀,则加入氯化钡产生白色沉淀的酸性溶液里一定含有硫酸 |
| D.原子、分子不带电,则不带电的微观粒子一定是分子和原子 |
在实验室配制溶液时,常涉及以下过程:①溶解 ②称量 ③计算 ④装瓶存
放。请回答问题:
(1)现欲配制50g 5%氯化钠溶液,配制过程的先后顺序是 (填序号)。
(2)用已调节平衡的托盘天平称取氯化钠固体时,发现指针偏右,接下来的操作是 。
(3)要配制245g质量分数为10 %的稀硫酸,需要溶质质量分数为98%的浓硫酸 g,在浓硫酸稀释过程中,一定要把 沿器壁慢慢注入 里,并不断搅拌。
在实验室配制质量分数一定的氯化钠溶液时,有下列图示的操作,其中肯定错误的是
(8分)钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源。
(1)海水制盐。从海水制取的粗盐中含有泥沙、硫酸镁和氯化钙等杂质,为得到较纯的氯化钠,将粗盐溶于水,然后进行如下操作:a.加过量的Ba(OH)2溶液;b.加适量的盐酸;c.加过量的Na2CO3溶液;d.过滤;e.蒸发。正确的操作顺序是___________(填字母)。加Na2CO3溶液的作用是除去________。
用提纯的NaCl配制200g0.9%的生理盐水,需要NaCl的质量为 g。
①配制该溶液时所需要的玻璃仪器有:
②如果配制后溶液溶质的质量分数低于0. 9%,你认为可能的原因是 (写一个即可)
(2)海水制镁。从海水中提取金属镁的过程如下图所示:
在上述转化过程中发生中和反应的方程式是 ________________ 。海水中本身就含有氯化镁,则①、②两步的作用是_______________
(3)海水“制碱”。氨碱法制纯碱中生成NaHCO3和NH4Cl的化学方程式为 _____
下图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是
| A.t2℃时,甲、乙两种物质的溶解度相等 |
| B.甲的溶解度随温度的升高而增大 |
| C.t1℃时,将25g丙加入到50g水中充分溶解能得到不饱和溶液 |
| D.分别将t3℃时甲、乙、丙的饱和溶液降温至t1℃,则所得的三种溶液中溶质的质量分数大小关系是乙>甲>丙 |
如图所示,甲、乙是两种物质的溶解度曲线,下列叙述正确的是
| A.40℃时,甲、乙两种物质的溶液中溶质的质量分数相等 |
| B.40℃时,甲、乙两种物质的溶解度相等 |
| C.采用降温的方法可将乙的不饱和溶液转化为饱和溶液 |
| D.60℃时,在100 g甲的饱和溶液中,含溶质甲60g |
实验室配制50 g 16%的氯化钠溶液的操作如下图所示。①中玻璃棒的作用是 ;称量的食盐质量为 ;该实验的正确操作顺序为 (填序号)。
水是重要的自然资源。
(1)湿衣服晾干体现了水分子的不断 。
(2)日常生活中,常用 的方法降低水的硬度。
(3)水可以配制各种溶液。将100 g溶质质量分数为98%的浓硫酸配制成10%的稀硫酸,需水的质量为 g。