在过氧化氢溶液的分解反应中,二氧化锰能作催化剂。
【提出问题】在过氧化氢溶液的分解反应中,除了二氧化锰,能否有其他物质也能作催化剂?
【查阅资料】在过氧化氢溶液的分解反应中,氧化铜也能作为催化剂
【进行实验】用天平称量0.2g氧化铜,取5mL5%过氧化氢溶液于试管中,进行如下实验:

(1)填写下表
| 步骤③现象 |
步骤⑥结果 |
步骤⑦现象 |
结论 |
| |
|
向步骤⑥得到的固体中再次加入过氧化氢,伸入带火星的木条, |
氧化铜也能作为过氧化氢分解的催化剂 |
(2)步骤①的目的 ;
(3)【拓展探究】设计如下四组实验,比较二氧化锰和氧化铜对过氧化氢溶液分解的催化作用,其中观察效果最差的____________
 |
第一组 第二组 第三组 第四组
A.第一组同时实验,观察比较反应过程中两个气球体积的变化
B.第二组同时实验,观察比较反应过程中两个试管内产生气泡的快慢
C.第三组分两次实验,看木条是否能复燃
D.第四组分两次实验,比较收集一定体积的气体所需要的时间
(4分)生活中有许多铜制品,如:铜暖手炉、铜雕塑、铜芯线、铜工艺品等等。
(1)其中作铜芯线是利用了铜的 (物理性质) 。
(2)东汉晚期的青铜奔马(马踏飞燕)是我国的旅游标志,但由于时间过长已经满身“绿锈”。和铁生锈类似,铜在空气中被腐蚀生成了绿色的碱式碳酸铜 ,根据它的组成判断,可能是铜和空气中的 、 、 (填化学式)共同发生了化学反应。
,根据它的组成判断,可能是铜和空气中的 、 、 (填化学式)共同发生了化学反应。
(3)孔雀石是一种主要含有绿色碱式碳酸铜的矿石。人们发现:森林火灾后,孔雀石表明往往有红色物质出现。提示:Cu2(OH)2CO3===2CuO+H2O+CO2↑试写出产生红色物质的其中一个化学方程式 。
(4)碱式碳酸铜又可以表示为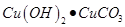 ,取少量碱式碳酸铜溶于适量稀盐酸中,得到蓝色的溶液,其溶质为 (填化学式)。
,取少量碱式碳酸铜溶于适量稀盐酸中,得到蓝色的溶液,其溶质为 (填化学式)。
写出符合下列要求的文字表达式或化学方程式.
(1)有氧化物生成的化合反应 .
(2)实验室用高锰酸钾制取氧气 .
(3)有白烟生成的反应 .
(4)实验室加热固体混合物制取氧气 .
(5)电解水 .
化学是研究物质的组成、结构、性质及其变化规律的基础自然科学,请回答下列问题:
(1)①从组成角度看:水是由 组成的。
②从微粒角度看:水是由 构成的。
③从资源角度看:水是生命之源,下图是用来净化河水的简易装置,下列说法错误的是 。
A.利用上图装置能把硬水变为软水
B.通过过滤可以除去水中所有的杂质
C.利用上图装置能对水杀菌消毒
④从变化角度看:水通电分解能生成最理想的能源 气,电解一定量的水,当其中一个电极产生5 mL气体时,另一电极产生的气体体积可能是 mL。
(2)水是很好的溶剂。下图是KNO3和KCl在不同温度时的溶解度,回答下列问题:
①t1℃时,两物质中溶解度较大的是 。
②t2℃时,两物质的等质量饱和溶液降温至t1℃,析出固体质量较多的是 的溶液。
③t2℃时,将100g水加入盛有50g氯化钾的烧杯中,充分溶解后,得到氯化钾的 (填“饱和”或“不饱和”)溶液。保持温度不变,往该烧杯中再加入10g水,充分搅拌后,氯化钾溶液的溶质的质量分数 (填“变大”或“不变”或“变小”)。
④欲配制溶质的质量分数为20%的硝酸钾溶液,应满足的温度范围是 。
二氧化硫是一种有害气体,它的排放会影响空气的质量。下列是有关二氧化硫的一些说法:①二氧化硫是无色有刺激性气味的气体; ②它的密度比空气大; ③加热并在有V2O5作催化剂的条件下可以与氧气发生反应生成三氧化硫; ④三氧化硫也可以分解生成二氧化硫和氧气; ⑤工业上常用二氧化硫来漂白纸浆、丝毛、草帽辫等; ⑥实验室常用亚硫酸钠固体与硫酸反应制取二氧化硫; ⑦二氧化硫可以用于消毒杀菌; ⑧二氧化硫易液化; ⑨二氧化硫易溶于水生成亚硫酸。
(1)以上描述中属于二氧化硫物理性质的是 ;属于二氧化硫化学性质的是 ,属于二氧化硫制法的是 (均填序号)。
(2)写出二氧化硫与氧气反应的化学方程式: 。
(10分)写出下列反应的化学方程式,并按要求填空。
(1)镁在氧气中燃烧: ,燃烧时发出 ,放出大量热。
(2)生石灰干燥食品: ,该反应属于 (填“放热”或“吸热”)反应
(3)用稀盐酸除铁锈: ,该反应属于 反应(填基本反应类型)。
(4)研磨硫酸铵与熟石灰的固体混合物: ,该反应产生的一种刺激性气味的气体可以用 石蕊试纸检验。
(5)将光亮的铁丝插入装有硫酸铜溶液中: ,反应所得溶液的质量 (填“大于”或“等于”或“小于”)反应前溶液的质量。
钙元素对人类生命和生活具有重要意义。
(1)在元素周期表中,钙元素的信息如右图所示。钙元素的相对原子质量为 。
(2)儿童缺钙可能会导致 (填“贫血症”或“佝偻病”)。
(3)氧化钙能与水反应,此反应可用于 (填字母序号)。
A.吸收水分 B.制熟石灰 C.加热食物
(4)熟石灰的化学式为 ,它可用于制备补碘剂 ,其中碘元素的化学价为 。
,其中碘元素的化学价为 。
(5)“冰洲石”(主要成分为 )制成的工艺品不能与盐酸接触,用化学方程式表示其原因: 。
)制成的工艺品不能与盐酸接触,用化学方程式表示其原因: 。
质量守恒定律的发现对化学的发展作出了重要贡献。


(1)用如下图所示的3个实验验证质量守恒定律,其中实验前后天平不能保持平衡的是 (填序号),理由是 。
(2)从微观角度分析有助于我们理解质量守恒定律。在一密闭容器内有4种物质A、B、C、D,它们在一定条件下发生化学反应。经过一段时间后停止反应,其中A、B、C、D的微观示意图和反应前后各物质的质量如下表所示。
| 物质 |
A |
B |
C |
D |
|
| 微观示意图 |
 |
 |
|||
| 反应前质量/g |
100 |
20 |
x |
y |
|
| 反应后质量/g |
32 |
140 |
126 |
46 |
(Ⅰ)从微观角度分析,化学反应中质量守恒的原因是 。
(Ⅱ)B的化学式为 。
(Ⅲ)该反应中B和C的质量比为 。
(Ⅳ)表中x的值是_____________________。
(6分)酸、碱、盐在生活中应用广泛。请根据图示回答相关问题:
(1)从微观角度看物质的变化是化学的思维方式之一。下图表示生成氯化钠的化学反应,该反应的化学方程式是 ,其微观实质是 。
(2)对比学习有利于发现事物的共性与个性。为探究酸的化学性质,某同学进行了如下实验。
| 实验内容 |
 |
 |
 |
| 实验现象 |
A试管内无明显现象,B试管中镁带表面观察到的现象是 。 |
C、D两试管中均观察到有气泡产生。 |
E试管中观察到的现象是 产生白色沉淀; F试管中无明显现象。 |
| 结论 |
酸的很多反应通常在水溶液中才能完成。 |
|
不同的酸根会导致酸的“个性”有差异。 |
请分析上述现象并回答:
清洗试管时,将C、F两试管中的无色液体同时倒入一个洁净的废液缸,废液缸中立刻冒气泡并出现白色沉淀。废液缸里最终产生的白色沉淀中一定含有硫酸钡,该反应的化学方程式为 ,白色沉淀中可能还含有 (填化学式)。
(8分)钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源。
(1)海水制盐。从海水制取的粗盐中含有泥沙、硫酸镁和氯化钙等杂质,为得到较纯的氯化钠,将粗盐溶于水,然后进行如下操作:a.加过量的Ba(OH)2溶液;b.加适量的盐酸;c.加过量的Na2CO3溶液;d.过滤;e.蒸发。正确的操作顺序是___________(填字母)。加Na2CO3溶液的作用是除去________。
用提纯的NaCl配制200g0.9%的生理盐水,需要NaCl的质量为 g。
①配制该溶液时所需要的玻璃仪器有:
②如果配制后溶液溶质的质量分数低于0. 9%,你认为可能的原因是 (写一个即可)
(2)海水制镁。从海水中提取金属镁的过程如下图所示:
在上述转化过程中发生中和反应的方程式是 ________________ 。海水中本身就含有氯化镁,则①、②两步的作用是_______________
(3)海水“制碱”。氨碱法制纯碱中生成NaHCO3和NH4Cl的化学方程式为 _____
下图是某化学反应的微观模拟图,其中“●”和“○”分别表示两种质子数不同的原子,a、b分别表示反应前和反应后的物质。请回答:
(1)将b中补充画出粒子的图形,使其表示正确;
(2)将图b补充完整,你补充的依据是 。
(3)反应物属于 (填物质分类),从微观角度说明你的判断依据是 ;
写出下列化学方程式
(1)二氧化碳与澄清石灰水反应
(2)碳酸氢钠与稀盐酸反应
(3)硫酸钠溶液与硝酸钡溶液反应
下图是初中化学一些常见物质之间转化的关系图(有些反应条件已省略)。其中,A、B、X、Y均为无色气体,E、F为常见金属。已知高温下CO能与多种金属氧化物反应生成相应金属和CO2。请按要求回答下列问题:
(1)B物质的化学式为________________;
(2)蓝色溶液与E反应的化学方程式为:_____ __________;
(3)黑色固体甲与X反应的化学方程式为:______ ___。
A—H都是初中化学中常见的物质,已知A、B都是黑色固体,D、F为红色固体,它们之间的转化关系如下图所示。请回答下列问题:
(1)写出反应①的化学方程式 。
(2)反应③在工业上常用于 。
(3)H溶液可能是 溶液(填化学式)。