同学在帮助老师整理实验室时,发现了半瓶久置的氢氧化钙粉末[Ca(OH)2],他们决定对这瓶氢氧化钙粉末的组成进行实验探究。
(1)提出问题:这瓶氢氧化钙是否已经变质?
(2)猜想与假设:该氢氧化钙粉末的成分为①氢氧化钙;②氢氧化钙、碳酸钙;③ 。
(3)设计方案、进行实验:请你参与探究,并填写下表。
| 实验步骤 |
实验现象 |
实验结论 |
| ①取样品少量于小烧杯中,加入适量水,充分搅拌,过滤。 |
|
|
| ② 。 |
大量气泡产生 |
氢氧化钙已经变质。 |
| ③取少量滤液于试管中, 。 |
|
氢氧化钙没有完全变质。 该反应的化学方程式为 。 |
(4)联想与启示:氢氧化钙变质是由于Ca(OH)2与空气中的 发生化学反应的缘故,因此氢氧化钙应 保存。
在学习了金属的性质后,化学实验小组同学对“21世纪的重要金属材料钛和钛合金”产生了兴趣,他们进行了如下探究,并请你一同参与。
查阅资料:
(1)钛的硬度与钢铁差不多,而它的质量只有同体积钢铁的一半,钛虽然稍比铝重一点,可它的硬度却比铝大两倍。
(2)钛属于化学性质比较活泼的金属,但在常温下钛的抗腐蚀性很强。有人曾把一块钛沉到海底,五年以后取上来,发现一点锈也没有生,依旧是亮光闪闪。
(3)钛具有“亲生物”性,在人体内能抵抗分泌物的腐蚀且无毒。
活动与探究:
(1)钛与铁的金属活动性哪一种强?
【提出假设】: 。
【设计实验】: 。
若钛的活动性比铁强,以上实验出现的现象是: 。
(2)钛是比较活泼的金属,为什么耐腐蚀性却很强?
可能的原因是: 。
(3)你想探究的问题是: 。
思考与应用:“物质的性质一定程度上决定它的用途”请判断钛有哪些用途?(要求两条)
根据初中化学知识,探究空气中氧气含量实验。小明根据所学内容,红磷、白磷、木炭、镁条都可以和氧气发生反应,但是哪种物质更适用于测定空气中氧气含量,小明进行如下探究。
【探究问题】红磷、白磷、木炭、镁条几种物质,哪种更适用于测定空气中氧气含量?
【查阅资料】
红磷、白磷对比情况
| |
红磷 |
白磷 |
| 状态 |
暗红色固体 |
蜡状固体 有毒 |
| 燃烧温度 |
240°C |
40°C |
镁条可以与空气中多种物质反应,如N2、CO2等
【探究过程】如下图所示,按照实验装置进行实验,探究几种物质测定空气中O2含量的可行性。
(1)红磷、白磷探究实验小明认为选用红磷进行实验,其原因是 。
| 实验步骤 |
实验现象 |
结论和化学方程式 |
如图所示,将足量红磷放到燃烧匙中,点燃红磷,进行实验 |
|
空气中氧气约占 化学方程式 |
(2)若将实验药品改为木炭,反应结束后降至室温,打开止水夹,水不倒吸入集气瓶的原因是 。
(3)若将实验药品改为镁条,反应结束后降至室温,观察到水倒吸入集气瓶大于1/5。根据资料信息,小明知道镁条可以与空气中的氮气、二氧化碳发生反应,进而影响反应结果。镁条与氮气反应可以生成氮化镁(Mg3N2)和碳,请写出相应的化学方程式 。
【探究结论】几种物质中,红磷是最适用于测定空气中氧气含量。
(1)某化学小组用火柴、蜡烛、大理石、烧杯、酒精灯、坩埚钳等实验材料,探究物质燃烧的条件。
【提出问题]】物质燃烧需要什么条件?
【猜想]】 假设1:有可燃物 , 假设2:温度要达到着火点, 假设3:与空气接触。
【设计实验】请在下表中根据假设,利用所给材料,设计完成探究实验。
| 验证 |
实 验 |
对 比 实 验 |
| 假设1 |
|
在空气中点燃蜡烛,蜡烛燃烧 |
| 假设2 |
|
在空气中点燃蜡烛,蜡烛燃烧 |
| 假设3 |
在空气中点燃蜡烛,蜡烛燃烧 |
|
(2)根据燃烧的条件,请用下列选项填空:若用扇子扇炉火,炉火不会熄灭,且越扇越旺,原因是 (填序号);用扇予扇然着的蜡烛,烛火立即熄灭,原因是 (填序号)。
A.可快速地提供燃烧所需的氧气
B.空气流动虽带走热量,但未使温度降到着火点以下
C.主要是空气流动带走热量,使温度降到着火点以下
已知某金属粉末中可能含有铁、铝、铜三种金属中的两种或三种,化学小组的同学对该粉末进行探究。
【提出猜想】
猜想一:该粉末由铜、铝组成; 猜想二:该粉末由铁、铝组成;
猜想三:该粉末由铁、铝、铜组成; 猜想四:该粉末由 ▲ 组成。
【查阅资料】铝与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气,反应的化学方程式为2Al + 2H2O + 2NaOH =" 2NaAlO2" + 3H2↑,铁和铜与氢氧化钠溶液均不发生反应。
【供选药品】稀盐酸、稀硫酸、氢氧化钠溶液、硫酸铜溶液、澄清石灰水、蒸馏水。
【进行实验】
| 实验目的 |
实验操作 |
实验现象 |
实验结论 |
| 证明粉末中是否含有 ▲ |
取一个小烧杯,加入适量的粉末,再向其中加入足量的 ▲ |
▲ |
猜想四成立; 实验中发生反应 的化学方程式为 ▲ |
| 证明粉末中是否含有 ▲ |
过滤,将得到的固体洗涤后放入小烧杯,再向其中加入足量的稀盐酸 |
▲ |
【反思与评价】若将原粉末中的铜全部回收,请写出实验过程 ▲ 。
过氧化钠(化学式为Na2O2)能与CO2反应,化学方程式为2Na2O2 + 2CO2 =" 2Na2CO3" + O2↑,可用在呼吸面具中作为氧气来源。某实验小组欲用干燥的二氧化碳与过氧化钠反应收集一瓶氧气,实验装置如下图所示,请回答问题。
⑴实验室制取二氧化碳的化学方程式为 ▲ 。
⑵浓硫酸的作用是 ▲ 。
⑶若实验过程中发现澄清的石灰水变浑浊,其原因可能为 ▲ ,发生反应的化学方程式为
⑷氧气可用E装置收集,并用带火星的木条检验,这是利用了氧气的 ▲ 性质
向a、b两支具支试管中加入形状和大小完全相同的铁片,再向a中加入植物油,分别塞上橡皮塞,U型玻璃管内为红墨水(开始时两端液面等高),如下图所示。放置一段时间后,下列叙述中,不正确的是
| A.两支试管中铁片均被锈蚀 |
| B.植物油的作用是隔绝氧气和水 |
| C.铁生锈的条件是与氧气和水同时接触 |
| D.U型玻璃管两端的液面变为左低右高 |
某实验小组探究火锅烟气中CO2、CO分别对人体血液供氧能力的影响。
设计装置如图所示(试管中均为稀释的新鲜鸡血):
① ② ③
实验记录:
| 操作步骤 |
现象 |
|
| I. |
分别向试管①、②、③中通入氧气 |
鸡血颜色为鲜红色 |
| II. |
向试管①中通入气体A; 停止通入A,向试管①中通入氧气 |
鸡血颜色由鲜红色变为桃红色 鸡血颜色不变 |
| III. |
向试管③中通入气体B; 停止通入B,向试管③中通入氧气 |
鸡血颜色由鲜红色变为暗红色 鸡血颜色由暗红色变为鲜红色 |
(1)向试管①中通入气体时,气体从导管口(填装置图中的序号) 处通入。
(2)试管②的作用是 。
(3)气体A为 。判断的依据是 。
(4)从安全和环保的角度来看,本实验需要改进的地方是 。
(5)通过实验可以得出结论,火锅烟气中对人体血液供氧量有影响的是(填具体物质) 。
化学实验小组同学对某小区下水管道中的气体样品进行研究。
已知:①下水管道气体中常含有二氧化碳、甲烷、氧气、氮气、硫化氢(H2S)等成分。
②硫化氢是一种无色、有臭鸡蛋气味的气体。H2S通入CuSO4溶液中,反应生成CuS沉淀和硫酸(H2SO4),从而除去H2S。该反应的化学方程式为 。
(1)该下水管道中的气体有特殊臭味,气体中一定含有的气体是 。将该下水管道中的气体通过CuSO4溶液。
(2)将步骤(1)处理过的气体通入澄清石灰水中,澄清石灰水变浑浊,说明该下水管道中的气体含有二氧化碳。该反应的化学方程式为 。
(3)收集1小试管经过步骤(1)处理过的气体,移近酒精灯火焰,听到尖锐的爆鸣声,说明该下水管道中的气体还含有的气体是 。该反应的化学方程式为
下表各组中,实验操作和目的对应关系不正确的是
|
催化剂在科研、医药生产和电子工业等前沿领域有着广泛应用。
(1)为探究二氧化锰对氯酸钾分解的催化作用。在相同条件下,同学们按下表进行实验并记录相关数据。(其他影响实验的因素均相同)
| 编号 |
KClO3质量/g |
其他物质质量/g |
待测数据 |
| 实验1 |
2.0 |
 |
|
| 实验2 |
a |
MnO2 0.5 |
|
① 表中a的数值应是 。
② 表中的待测数据指 (填字母序号)。
| A.氧气的质量 | B.反应后固体的质量 |
| C.氧气的体积 | D.单位时间内产生氧气的体积 |
 ③ 设计“实验1”的目的是 。
③ 设计“实验1”的目的是 。
(2)同学们继续探究二氧化锰是否参与了氯酸钾的分解反应。
氯酸钾和二氧化锰混合加热的化学方程式为:2KClO3="===2KCl" + 3O2↑。已知氯酸钾与二氧化锰混合加热时连续发生如下反应,试分析后按要求填空。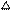 (I) 2KClO3 + 2MnO2="==2KMnO4" + Cl2↑+ O2↑;
(I) 2KClO3 + 2MnO2="==2KMnO4" + Cl2↑+ O2↑;
(II) (用化学方程式表示); (III)K2MnO4 + Cl2="==2KCl" + MnO2 + O2↑。
(III)K2MnO4 + Cl2="==2KCl" + MnO2 + O2↑。
通过以上分析,同学们得出结论:二氧化锰参与了氯酸钾的分解反应。
【拓展】氟利昂释放出的氯原子参与了臭氧层的破坏,其微观示意图如下: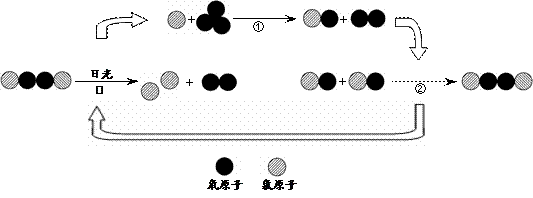
综合图中①②③的反应过程,写出臭氧层被破坏的化学方程式
请根据下图所示实验,回答问题。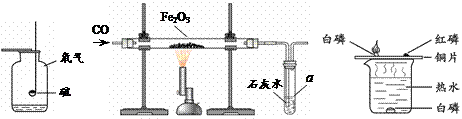
甲 乙 丙
(1)甲中可观察到硫在氧气中燃烧,发出 火焰,此反应的化学方程式是 。
(2)乙中仪器a的名称是 ,玻璃管中的现象是 。该装置的不足之处是 。
(3)丙中铜片上的现象是 ,由此得出可燃物燃烧的条件是
化学小组同学在加热二氧化锰样品时,发现有气泡产生(如图一所示),于是他们对这个异常现象进行了探究。
(1)对气体成分的探究:加热二氧化锰样品,用燃着的木条靠近试管口,木条熄灭。将气体通入澄清的石灰水,发现石灰水变浑浊,产生的气体是 。
(2)对气体来源的探究:
【假设1】甲同学认为:该气体来自于试管中的空气,请你设计实验证明该假设不成立
| 实验步骤及现象 |
结论 |
| |
假设不成立。 |
【假设2】乙同学认为:二氧化锰样品中可能混有炭粉,炭粉发生反应生成了该气体。他设计了如图二所示的实验进行研究,其中B装置的作用是检验A中反应是否完全,B中的试剂是 ,实验中观察到D处澄清石灰水变浑浊。他又用氮气代替空气(氮气不参与该实验中的任何反应),重复上述实验,发现D处澄清的石灰水也变浑浊。
【结论】通过乙同学的实验证明,二氧化锰中混有炭粉,炭粉与 反应产生了这种气体
(7分) 科技节活动中,化学实验小组做了如下实验,请回答以下问题。
(1)图A所示实验可观察到“铁树”上浸有无色酚酞试液的棉团由白色变为 色,该实验中没有涉及的性质是 (填字母)。
A.氨分子是不断运动的 B.氨分子有一定质量 C.浓氨水具有挥发性
(2)图B所示实验,将注射器中浓石灰水注入瓶中,会看到鸡蛋被“吞”入瓶中,该实验中涉及的化学方程式为 。
(3)图C所示实验,当通过导管向热水中通入氧气时,白磷在水下燃烧,该实验说明燃烧需要的条件为:①可燃物;②达到燃烧所需要的 ;③ ,反应的化学方程式为 。
(4)图D所示实验观察到紫色小花变为红色,小花变红的原因是 (用化学方程式表示)
(6分)
长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体。甲、乙两位同学发现往水中投入过氧化钙时产生气泡。
(1)提出问题:当把过氧化钙投入足量水中时,最终会生成什么物质呢?
(2)进行猜想:甲同学认为:生成氧化钙和氧气;
乙同学认为:生成氢氧化钙[Ca(OH)2]和氧气。
你认为 同学的猜想是错误的,其理由是 。
(3)设计实验:验证另一个同学的猜想是正确的,并填入下表空格中。
| 实验方法 |
实验现象 |
实验结论 |
| ①取少量过氧化钙放入试管中,加足量水,将带火星的木条伸进试管中。 |
|
有氧气生成 |
| ②取实验①静置后的上层清夜, 。 |
|
|