北京市通州区初三上学期末化学卷
水在实验室和日常生活中有着十分重要的作用。
(1)在实验室里,水除了可以用来刷洗仪器,还可以 (写出一种用途即可);
(2)医院在给病人输液时,常使用0.9%生理食盐水,该食盐水中溶质与溶液的质量比为_________;现要配制500g溶质的质量分数为0.9%生理食盐水,需要水的质量是_________。
(3)20℃时,分别向盛有10g水的两支试管中,加入等质量的甲、乙两种固体物质,使其充分溶解,可观察到如下图1所示的现象。
①20℃时, (填“A”或“B”)试管中的溶液一定是饱和溶液;
②上图图2中表示甲物质的溶解度曲线的是 (填“a”或“b”),
要使A试管中剩余的固体继续溶解可采用的方法是 。
(1)下图表示物质分类和转化关系。请按要求填空。
① A处物质类别是 ;
② B处物质类别及物质示例是 、 。
③ C处对应的是_________________(填“物理变化”或“化学变化”)。
(2)应用质量守恒定律进行判断:取A、B、C三种物质各20g,在一定条件下充分化合只能生成42g新物质D。若增加5gA,充分反应后原反应物中只有C剩余。
下列说法正确的是 (填字母序号)。
A.该反应是化合反应 B.第一次反应停止后,C剩余14g
C.反应中A和B的质量比是5︰4 D.两次反应后,生成D的总质量为52.5g
A、B、C、D、E是初中化学常见的五种物质。请回答下列问题:
(1) A是一种理想的燃料,则A是_____。写出A在空气中燃烧的化学方程式____。
(2)B是一种无色液体,在某种黑色固体催化下生成一种可供给呼吸的气体,该反应的化学方程式是____________。
(3)C能与上述两个反应的共同产物发生化合反应,该反应的化学方程式为_______,D在空气中充分燃烧能生成C,D是一种含两种元素的不同类型的化合物,则D可能是________(写出两种物质的化学式)。
(8分)下图是实验室中用于制取和收集气体的装置图,请回答以下问题:
(1)写出上图中带标号仪器的名称:①__________,②____________。
(2)用高锰酸钾制取氧气,发生装置选择_____(填字母序号,下同),反应的化学方程式为_______________________________________________。
(3)实验室制取二氧化碳,应选用的固体药品是_______,收集装置选择______。请写出用澄清石灰水检验二氧化碳的化学方程式____________________。
(4)下图是某同学放置在桌面上的一瓶初中常见的无色纯净气体,你认为该气体可能是________(写一种即可)。
请根据不同的实验内容回答对应的问题。
| 实验内容 |
回答问题 |
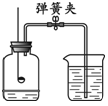 ⑴测定空气的成分 |
①该实验可得出:空气中氧气体积分数约为 。 ②写出红磷发生燃烧反应的化学方程式 。 |
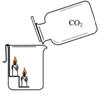 ⑵探究二氧化碳的性质 |
③该实验过程中,可观察到的现象是 。 ④从实验现象得出,二氧化碳具有的性质是 。 |
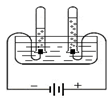 ⑶电解水 |
⑤从该实验中得出的正确结论有 (填字母序号)。 A.水由氢和氧两种元素组成 B.电解水产生的氢气和氧气的体积比约为2﹕1 C.一个水分子由二个氢原子和一个氧原子构成 D.化学反应中,分子可以再分,原子不能再分 |
(1)某化学小组用火柴、蜡烛、大理石、烧杯、酒精灯、坩埚钳等实验材料,探究物质燃烧的条件。
【提出问题]】物质燃烧需要什么条件?
【猜想]】 假设1:有可燃物 , 假设2:温度要达到着火点, 假设3:与空气接触。
【设计实验】请在下表中根据假设,利用所给材料,设计完成探究实验。
| 验证 |
实 验 |
对 比 实 验 |
| 假设1 |
|
在空气中点燃蜡烛,蜡烛燃烧 |
| 假设2 |
|
在空气中点燃蜡烛,蜡烛燃烧 |
| 假设3 |
在空气中点燃蜡烛,蜡烛燃烧 |
|
(2)根据燃烧的条件,请用下列选项填空:若用扇子扇炉火,炉火不会熄灭,且越扇越旺,原因是 (填序号);用扇予扇然着的蜡烛,烛火立即熄灭,原因是 (填序号)。
A.可快速地提供燃烧所需的氧气
B.空气流动虽带走热量,但未使温度降到着火点以下
C.主要是空气流动带走热量,使温度降到着火点以下
味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式是C5H8NO4Na)。某品牌味精包装上标注内容
如图所示,请回答:
(1)谷氨酸钠的相对分子质量为_______。
(2)谷氨酸钠中氢元素与氧元素的质量比为 。
(3)该味精每包含钠元素的质量为_______g。
某化学兴趣小组为测定某大理石样品中碳酸钙的含量,将适量的稀盐酸加入到20 g大理石中(其它成分不与盐酸反应),再将产生的CO2气体用足量的澄清石灰水吸收,同时测量2分钟内石灰水增加的质量,结果如下表所示:
| 时间/s |
0 |
20 |
40 |
60 |
80 |
100 |
120 |
| 石灰水增加的质量/g |
0 |
3.0 |
5.0 |
6.0 |
6.6 |
6.6 |
6.6 |
(1)共产生二氧化碳气体 g。
(2)计算大理石样品中碳酸钙的质量分数(写出计算过程)
2010年上海世博会开幕式的精彩表演中,发生化学变化的是
| A.焰火表演 | B.霓虹灯表演 | C.音乐喷泉 | D.气球升空 |
下列清洗方法中,利用乳化原理的是
| A.用自来水洗手 | B.用洗涤剂清洗餐具 | C.用盐酸除水垢 | D.用汽油清洗油污 |
下列化学用语中,正确的是
| A.2个氧分子:2O | B.氧化钠:NaO |
| C.3个钠离子:3Na+ | D.2H2O的相对分子质量为20 |
吸烟有害健康,非吸烟者往往会因吸烟者吸烟而造成被动吸烟,这是因为
| A.分子在不断运动 | B.分子之间有间隔 | C.分子的体积很小 | D.分子的质量很小 |
在三个集气瓶中分别盛有空气、二氧化碳和氧气。将燃着的木条依次插入各瓶中,观察到的现象分别是继续燃烧、火焰熄灭、燃烧更旺。则三瓶气体依次是
| A.氧气、空气、二氧化碳 | B.空气、二氧化碳、氧气 |
| C.二氧化碳、空气、氧气 | D.空气、氧气、二氧化碳 |
根据你的生活经验和所学知识判断,下列做法合理的是
| A.若电脑着火,立即用水浇 | B.室内起火立即打开所有的门窗 |
| C.炒菜时油锅不慎着火,迅速盖上锅盖 | D.夜晚发现液化气泄漏,立即开灯检查 |
2010年2月19日德国重粒子研究中心宣布原子序数为112号的元素符号为Cn,其相对原子质量为277。下列有关112号元素的说法正确的是
| A.该元素原子的核电荷数为277 | B.该元素原子的质子数为165 |
| C.该元素原子的中子数为112 | D.该元素原子的核外电子数为112 |
下列有关“物质——性质——用途”的叙述中,用途与性质不相关的是
| 序号 |
物质 |
性质 |
用途 |
| A |
干冰 |
升华时吸收热量 |
制冷剂 |
| B |
活性炭 |
吸附性 |
防毒面具 |
| C |
氧气 |
助燃性 |
医疗急救 |
| D |
木炭 |
可燃性 |
做燃料 |
100g溶质质量分数为30%的硫酸加水稀释成溶质质量分数为10%的硫酸溶液,需加水
| A.300g | B.200g | C.150g | D.100g |
在“宏观——微观——符号”之间建立联系是化学学科特有的思维方式。下图是某化学反应的微观模拟示意图,根据该图判断下列说法中正确的是
| A.图中的反应物都是单质 | B.该反应属于分解反应 |
| C.化学反应前后碳元素化合价没有改变 | D.该反应的化学方程式是 |
下列图中所给信息与叙述不一致的是( )
| A.封闭在某容器中的少量液态水 (该容器的活塞可以左右移动)煮沸后变成水蒸气的微观示意图 |
| B.向一定量的石灰水中通入过量的二氧化碳,x轴表示二氧化碳的质量,y轴表示沉淀的质量 |
| C.两份完全相同的过氧化氢溶液,一份(a)加入少量的二氧化锰,另一份(b)中不加二氧化锰,再分别使其完全反应,纵坐标为放出氧气的质量m,横坐标为反应时间t |
| D.一定温度,向100g水中逐渐加入硝酸钾晶体至饱和,纵坐标为溶解度S,横坐标为溶质质量m |
水是生命之源,它与我们的生活密切相关。
(1)除去食盐水中混有的泥沙,操作方法是 。
(2)下列为净化水的操作,其中净化程度最高的是 。
A. 吸附 B. 蒸馏 C. 过滤 D.静置沉淀
(3)世博园直饮水主要生产流程为:自来水→活性炭→超滤膜分离→紫外线消毒→直饮水,其中活性炭起____作用。
(4)下图为电解水的装置,A、B试管中得到的气体体积比为 ,通过此实验证明水是由 组成的,该反应的化学方程式为 。
(5)水既普通又珍贵。下列对水的“多”与“少”的描述正确的是 。
A.地球上总的水量多,淡水少 B.我国水资源总量多,人均淡水量少
C.“南水北调”工程说明南方水的储量多,北方水的储量少
D.生活中接触的纯净水多,水溶液少
化学用语是学习化学重要的工具,下表是元素周期表中的部分信息,请回答下列问题。
| 1 H 氢 1.008 |
|
|
|
|
|
|
|
2 He 氦 4.003 |
| 3 Li 锂 6.941 |
4 Be 铍 9.012 |
|
5 B 硼 10.81 |
6 C 碳 12.01 |
7 N 氮 14.01 |
8 O 氧 16.00 |
9 F 氟 19.00 |
10 Ne 氖 20.18 |
| 11 Na 钠 22.99 |
12 Mg 镁 24.31 |
13 Al 铝 26.98 |
14 Si 硅 28.09 |
15 P 磷 30.97 |
16 S 硫 32.06 |
17 Cl 氯 35.45 |
18 Ar 氩 39.95 |
|
| 19 K 钾 39.10 |
20 Ca 钙 40.08 |
…… |
|
|
|
|
|
|
(1)地壳中含量最多的元素是__________。
(2)从上表中可知,镁元素的相对原子质量为___________,它属于___________
(填“金属”或“非金属”)元素。
(3)由原子序数为11和17的元素形成化合物的化学式为___________。
(4)善于总结和发现是学好化学的一种重要途径,请写出表中你发现的一条规律________。
溶液在生产和生活中有重要意义。
(1)配制500g0.9%的生理盐水需要称量氯化钠 g,完成此实验正确的操作顺序是
(填序号) ;
①溶解 ②称量 ③计算 ④量取
(2)下图是A、B、C三种固体物质的溶解度曲线,A、C两种物质溶解度曲线的交点为P。回答下列相关问题:
①t1℃时,交点P的含义是 。
②t2℃时,A、B、C三种物质的溶解度从大到小的关系是 。
③t2℃时,将A、B、C三种物质各25g分别放入100g水中,充分溶解后,能形成饱和溶液的是 ,将其转化为不饱和溶液可采用的方法有 、 。
④将t1℃时A、B、C三种物质的饱和溶液升温到t2℃,所得溶液中溶质的质量分数最大的是 。
请你应用质量守恒定律完成下列各题。
(1)世博会已有千辆新能源汽车投入运行,其中部分公交车采用二甲醚(C2H6O)做燃料。二甲醚分子中C、H、O元素的原子个数比为 。
(2)某化合物在纯氧中充分燃烧后,只生成水和二氧化碳,该物质中 。
A. 只含有碳元素
B. 只有氢元素
C. 一定含有碳、氢两种元素,可能含有氧元素
D. 一定有碳、氢、氧三种元素
(3)黑火药点燃时发生如下反应:2KNO3+S+3C K2S+3CO2↑+X↑,其中X的化学式为 。
K2S+3CO2↑+X↑,其中X的化学式为 。
(4)下图给出的是某反应在同一容器中反应前后的分子种类。
反应前 反应后
①化学反应中,参加反应的 和生成的
和生成的 的质量比为 。
的质量比为 。
②由此可知,在化学反应前后,一定不变的是 (填数字序号)。
a. 原子种类 b. 原子数目 c. 分子种类
d. 分子数目 e. 元素种类 f. 物质的总质量
A、B、C、D、E、F都是初中化学常见的物质。它们之间的关系如下图所示(图中“—”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系)。
试推断:
(1)物质B的化学式为 。
(2)请写出A→C的化学方程式 。
(3)E→C+D的基本反应类型是 。
(4)请写出D→F的化学方程式 。
请看图回答问题: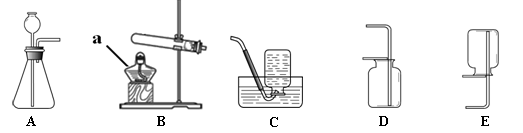
(1)图中仪器a的名称是 。
(2)用B与C相连可以制备 ,该反应的化学方程式为 。
(3)实验室制取二氧化碳应选用的发生装置和收集装置为_______(填序号),选用此收集方法的依据是 。
请根据下图A、B所示的化学实验(装置B铁架台已略去),回答以下问题。 
A B
(1)装置A 中,对比现象①②说明物质燃烧需要 ;对比现象①③说明两种可燃物的
不同;实验中水在其中的主要作用是 。
(2)装置B是二氧化碳的制备和性质实验。实验进行一段时间后,“人”字管左端发生反应的化学方程式为 ,右端可以观察到的现象是 。
(3)装置B的干燥管中被石蕊溶液浸湿的纸质小花的颜色变化为 ;请你设计实验证明小花颜色发生变化的原因,写出主要操作过程、实验现象和结论 。
根据初中化学知识,探究空气中氧气含量实验。小明根据所学内容,红磷、白磷、木炭、镁条都可以和氧气发生反应,但是哪种物质更适用于测定空气中氧气含量,小明进行如下探究。
【探究问题】红磷、白磷、木炭、镁条几种物质,哪种更适用于测定空气中氧气含量?
【查阅资料】
红磷、白磷对比情况
| |
红磷 |
白磷 |
| 状态 |
暗红色固体 |
蜡状固体 有毒 |
| 燃烧温度 |
240°C |
40°C |
镁条可以与空气中多种物质反应,如N2、CO2等
【探究过程】如下图所示,按照实验装置进行实验,探究几种物质测定空气中O2含量的可行性。
(1)红磷、白磷探究实验小明认为选用红磷进行实验,其原因是 。
| 实验步骤 |
实验现象 |
结论和化学方程式 |
如图所示,将足量红磷放到燃烧匙中,点燃红磷,进行实验 |
|
空气中氧气约占 化学方程式 |
(2)若将实验药品改为木炭,反应结束后降至室温,打开止水夹,水不倒吸入集气瓶的原因是 。
(3)若将实验药品改为镁条,反应结束后降至室温,观察到水倒吸入集气瓶大于1/5。根据资料信息,小明知道镁条可以与空气中的氮气、二氧化碳发生反应,进而影响反应结果。镁条与氮气反应可以生成氮化镁(Mg3N2)和碳,请写出相应的化学方程式 。
【探究结论】几种物质中,红磷是最适用于测定空气中氧气含量。
维生素C含片是保健食品,下图是XX牌维生素C含片的标签。
请计算:
(1) 维生素C的相对分子质量;
(2) 维生素C中碳、氢、氧元素的质量比;
(3) 维生素C中氧元素的质量分数。
老师安排同学们做测定某固体混合物中CaCO3质量分数的实验
(固体混合物中杂质不溶于水,也不与盐酸反应)。
利用电子天平测定的有关实验数据如下表:
| 称量项目 |
质量/g |
| 固体混合物 |
10.00 |
| 锥形瓶 |
100.00 |
| 锥形瓶+稀盐酸(足量) |
141.20 |
| 锥形瓶+稀盐酸+固体混合物(反应开始15秒) |
149.20 |
| 锥形瓶+稀盐酸+固体混合物(反应开始35秒) |
149.00 |
| 锥形瓶+稀盐酸+固体混合物(反应开始55秒) |
149.00 |

(1)生成二氧化碳多少克?
(2)固体混合物中CaCO3的质量分数是多少?
(3)生成物CaCl2溶液中溶质的质量分数是多少?
日常生活中的下列变化,属于化学变化的是
| A.菜刀生锈 | B.瓷碗破碎 | C.氧气加压变为淡蓝色液态氧 | D.灯泡通电后发光 |
下列各物质应用中,主要利用了其化学性质的是 ( )
| A.金属丝用做导线 | B.二氧化碳用于灭火 |
| C.氢气用作高能燃料 | D.活性炭用于吸附臭味 |
下列有关双氧水(H2O2)的组成说法中,正确的是 ( )
| A.由氢气和氧气组成 | B.由氢元素和氧元素组成 |
| C.由两个氢原子和两个氧原子组成 | D.由一个氢分子和一个氧分子组成 |
下列各项净化水的操作中,净化程度由低到高的顺序是 ( )
① 静置沉淀 ② 吸附沉淀 ③ 过滤 ④ 蒸馏
| A.① ③ ② ④ | B.① ③ ④ ② |
| C.④ ③ ② ① | D.① ② ③ ④ |
下列各组物质中,可属于同一类物质的一组 是 ( )
| A.O2、N2、CO2 | B.N2、CO、H2O |
| C.O2、CO2、SO2 | D.H2O、CO2、CH4 |
下列各粒子中,能直接构成物质的是 ( )
① 分子 ② 原子 ③ 质子 ④ 电子 ⑤ 离子
| A.① ② ③ | B.② ③ ④ |
| C.① ② ⑤ | D.① ③ ④ ⑤ |
保持二氧化碳化学性质的粒子是 ( )
| A.氧原子和碳原子 | B.碳原子和氧分子 |
| C.二氧化碳的分子 | D.碳元素和氢元素 |
下列现象中,分子发生了变化的是 ( )
| A.水分蒸发 | B.干冰升华 | C.水冻成冰块 | D.水通电时产生氢气和氧气 |
将2g镁条在空气中充分燃烧后,其生成物的质量应是 ( )
| A.小于2g | B.等于2g | C.大于2g | D.无法确定 |
从可燃物在空气中能够燃烧的事实,可知空气中一定含有的物质是( )
| A.氮气 | B.氧气 | C.二氧化碳 | D.稀有气体 |
每年进入冬季时,市政府有关部门都要提醒市民,冬季燃煤取暖要注意室内通风,以免造成人员中毒事故发生。这里的有毒气体主要指的是 ( )
| A.NO2 | B.SO2 | C.CO | D.CO2 |
下列有关金刚石和石墨的认识归纳中,不正确的是 ( )
| A.组成元素种类相同 | B.是性质不同的两种物质 |
| C.性质不同是构成原子的种类不同 | D.物理性质不同,化学性质相同 |
下列各组混合物遇到明火时,不可能发生爆炸的一组是 ( )
| A.氢气和空气 | B.天然气和空气 | C.二氧化碳和空气 | D.液化石油气和空气 |
燃烧、缓慢氧化、自燃的相同点是 ( )
| A.都产生发光放热现象 | B.都发生了氧化反应 |
| C.都发生了剧烈的化学反应 | D.都达到了可燃物的着火点 |
下列有关铝、铁、铜、银四种金属的共同性质归纳中,不正确的是 ( )
| A.都有导电性和延展性 | B.都能和稀盐酸反应制取氢气 |
| C.都是由原子直接构成的物质 | D.常温下状态相同金属光泽不同 |
下列常见现象中,能够将二氧化碳转化为氧气的是 ( )
| A.物质的三态变化 | B.动植物的呼吸 |
| C.燃料的充分燃烧 | D.植物的光合作用 |
金属钛(Ti)是重要的航空航天材料。它可用TiO2与Si在高温下反应制取,其反应的化学方程式为:TiO2+Si SiO2+Ti。你认为该反应的类型是 ( )
SiO2+Ti。你认为该反应的类型是 ( )
| A.化合反应 | B.分解反应 | C.置换反应 | D.无法确定 |
下列常见物质中,属于易燃、易爆物质的是 ( )
① 食盐 ② 味精 ③ 酒精 ④ 汽油 ⑤ 液化石油气
| A.①、②、③ | B.②、③、④ |
| C.③、④、⑤ | D.②、③、④、⑤ |
下列某小组同学设计的四组试剂中,能用来验证活动性锌>铜>银的是( )
① 锌、银、硝酸铜溶液 ② 银、硝酸锌溶液、硝酸铜溶液
③ 铜、硫酸锌溶液、硝酸银溶液 ④ 锌片、铜片、稀盐酸、硝酸银溶液
| A.①、② | B.②、③ | C.③、④ | D.①、③、④ |
化学与日常生产、生活密切相关。
(1)下列物质中,属于化石燃料的是 (填写序号,下同),属于最清洁燃料的是 。
①酒精 ②无烟煤 ③乙醇汽油 ④氢气 ⑤天然气
(2)下列日常生活中的一些做法,符合“低碳生活”理念的是 。
| A.随手关灯 | B.双面使用纸张 |
| C.充分利用太阳能 | D.减少使用一次性木筷 |
(3)在我国农村,可利用沼气解决生活用燃料问题,沼气中的甲烷含量达60%左右。请写出甲烷燃烧的化学方程式
(1)下图为A、B两种元素的原子结构示意图,
请据图回答下列问题:
①B元素原子的核电荷数为 。
②A元素和B元素的本质区别是 。
③B元素的单质在常温下就能与A元素的单质反应生成一层致密的氧化物保护膜,请写出该反应的化学方程式 。
(2)一氧化碳和二氧化碳只有一字之差,有人认为二者的性质相差甚远,请你写出一条支持他的理由
(1)下列物质中,属于纯净物的是 (填写序号,下同),属于化合物的是 。
①液态氧 ②蒸馏水 ③干冰 ④天然气 ⑤18K黄金
(2)下图为某化学变化的微观模拟示意图,其中的“ ”为碳原子、“
”为碳原子、“ ”为氧原子。
”为氧原子。
请你据图回答下列问题:
①上图各物质中不属于化合物的是 ;
②上图所示反应的化学方程式为 ;
③该反应中,A、B、C三种物质的质量比为
(1)在下列各物质中,能够供给人和动植物呼吸的是 (填写序号,下同),能够用于灭火的是 。
①氧气 ②水 ③氮气 ④一氧化碳 ⑤二氧化碳
(2)生活中常见的一些铁制品如铁钉、铁锅、菜刀等若保管不当会生锈。铁制品生锈
的原因是 ;要防止铁制品生锈,在家庭中一般可采取的措施是 (写出两种)。
(3)将生锈的铁钉投入到稀盐酸中,过一会儿才有气泡产生。
该过程的有关反应化学方程式为
由H、C、O、Fe四种元素组成的初中化学常见的五中物质间有如下图所示的关系,其中的甲、乙、丙是单质,X、Y是化合物。图中“ ”表示相连的物质间两两可以发生反应,“
”表示相连的物质间两两可以发生反应,“ ”表示某物质通过相应化学反应可制得另一种物质。若已知乙和丙反应能生成Y,请回答:
”表示某物质通过相应化学反应可制得另一种物质。若已知乙和丙反应能生成Y,请回答: 
(1)推断物质的名称:甲 ,乙 。
(2)写出下列反应的化学方程式:
①乙——丙: 。 ②X 甲: 。
②X 甲: 。
(1)按图测定空气中氧气的含量时,要达到实验目的,反应物或装置方面应满足的条件是 ;该实验还可说明氮气具有的性质是 (要求两条)。
(2)在探究两种未知的银白色金属X和Y的活动性顺序时,某小组同学做了下列实验:
①请你一同完成好如下实验报告,并回答下列问题。
| 实验步骤 |
实验现象 |
结 论 |
| 分别把这两种金属放入___________中观察。 |
金属X无明显变化;金属Y的表面有大量气泡冒出。将燃着的木条放在金属Y的试管口时,气体发生燃烧。 |
金属活动顺序为: |
②在进行上述实验之前,若老师告诉你X、Y可能是锌和银中的各一种,请你根据实验结果确定X应该为 (用化学式回答);
③小红同学提出,还可以用其他方法验证X和Y的活动性。请你帮她补充完整: 。并用有关的化学反应方程式说明你的理由:
根据下列实验装置图回答:(仪器装置可用序号填写)

A B C D E
(1)写出标有序号的仪器名称:① ② 。
(2)用高锰酸钾制取氧气应选用的发生装置是 ,收集装置是 ;
反应的化学方程式为 。
(3)在实验室制取二氧化碳时,可选用的装置是 ,再加入药品前,应首先注意检查装置的 ;该反应的原理为(用化学方程式表示) 。
在学习了金属的性质后,化学实验小组同学对“21世纪的重要金属材料钛和钛合金”产生了兴趣,他们进行了如下探究,并请你一同参与。
查阅资料:
(1)钛的硬度与钢铁差不多,而它的质量只有同体积钢铁的一半,钛虽然稍比铝重一点,可它的硬度却比铝大两倍。
(2)钛属于化学性质比较活泼的金属,但在常温下钛的抗腐蚀性很强。有人曾把一块钛沉到海底,五年以后取上来,发现一点锈也没有生,依旧是亮光闪闪。
(3)钛具有“亲生物”性,在人体内能抵抗分泌物的腐蚀且无毒。
活动与探究:
(1)钛与铁的金属活动性哪一种强?
【提出假设】: 。
【设计实验】: 。
若钛的活动性比铁强,以上实验出现的现象是: 。
(2)钛是比较活泼的金属,为什么耐腐蚀性却很强?
可能的原因是: 。
(3)你想探究的问题是: 。
思考与应用:“物质的性质一定程度上决定它的用途”请判断钛有哪些用途?(要求两条)
蛋白质是构成细胞的基本物质,是机体生长及修补受损组织的主要原料,它在人体胃肠内与水反应,最终生成氨基酸被人体吸收。丙氨酸(C3H7O2N)就是其中的一种。请回答下列问题:
(1)丙氨酸中所含C、H、O、N各元素的质量比为__________________。
(2)丙氨酸中含有氮元素的质量分数是多少?
(3)已知合格的奶粉每100g中含有蛋白质约18g,,蛋白质中氮元素平均质量分数为16%。若现测定某奶粉每100g中含氮元素的质量2g,试通过计算判断该奶粉是否属合格奶粉?




 不能确定的是
不能确定的是
 粤公网安备 44130202000953号
粤公网安备 44130202000953号