北京市石景山区初三第一学期期末化学卷
(5分)右图是硝酸钾溶解度曲线。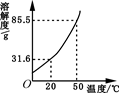
(1)硝酸钾溶液中的溶剂是 。
(2)从右图溶解度曲线可以得到的信息是______(写一条即可)。
(3)欲将一瓶接近饱和的硝酸钾溶液变成饱和溶液,可采取的
方法是 (写出一种即可)。
(4)小明在20℃时进行了如下实验,得到相应的溶液①~⑤,下列说法正确的是 。
| A.④中溶质的质量分数最大 | B.②⑤中溶质的质量分数相等 |
| C.①③④中没有固体存在 | D.②④⑤的溶液为饱和溶液 |
下列用字母表示的8种物质由H、C、O、Ca、Cl、Mn中的几种元素组成,它们是初中化学常见的物质。
(1)上述6种元素中属于金属元素的是 。
(2)A是大理石的主要成分,遇B溶液产生气泡,该反应的化学方程式为 。
(3)向X溶液中加入Y会生成Z和W,其中X、Z组成元素相同。X的化学式为 ,
W的化学式为 。
(4)向Z中加入M,发生化合反应生成N,M和N含有相同的金属元素。该反应的化学 方程式为 。
(5)从上述物质中任选2种为一组,按下图所示装置进行实验。将胶头滴管中的液体滴入瓶中,导管口处有气泡产生。写出符合要求的3组物质。
友情提示:填写物质的化学式、名称或俗称均可。
在实验课上,老师要同学们配制15%的氯化钠溶液50 g。
(1)计算:配制15%的氯化钠溶液50 g,需氯化钠的质量为 g,水的体积为
mL。
(2)甲同学按下图所示步骤依次操作。
其错误的操作步骤有 和 (填字母序号);B中仪器名称为 ;
E中玻璃棒的作用是 。
(3)乙同学在将称量好的氯化钠倒入烧杯中时,不小心有一部分氯化钠固体撒出,则其所配溶液溶质质量分数与15%相比 (答“偏低”、“偏高”、或“相等”)
下图所示是气体制取与性质验证的组合实验。打开A中分液漏斗活塞后,A、B、C、D、E中均可观察到明显现象。
(1)A中发生反应的化学方程式为 。
(2)B中的现象是 ,发生反应的化学方程式为 。
(3)E中的现象是 ,发生反应的化学方程式为 。
(4)用F装置收集气体的依据是 。
亚硝酸钠(NaNO2)是一种外观极像食盐,且具有与食盐一样咸味的有毒物质,因此,这种工业盐常被冒充食盐掺假或被误作食盐使用,导致多起中毒事故发生。某校化学实验室有一瓶标签破损的试剂瓶,盛放的药品可能是氯化钠固体,也可能是亚硝酸钠固体,该校化学小组同学通过实验手段确定该瓶盛放的药品的成分。
其主要探究过程如下:
【提出假设】该药品的成分是NaCl。
【查阅资料】
| |
亚硝酸钠 |
氯化钠 |
| 溶解性 |
15℃时溶解度为81.5g |
15℃时溶解度为35.8g |
| 熔点 |
271℃ |
801℃ |
| 沸点 |
320℃时发生分解有氧气等气体产生 |
1413℃ |
【实验过程】化学小组同学根据自己的假设,设计实验验证。请你帮助他们完成实验报告。
(1)小华同学设计的实验如下:
| 实验装置 |
实验主要过程 |
 |
①检查装置气密性。操作如下:先将导管伸入液面下,用手紧握试管,观察到 ,松开手后,导管口有液面上升。 ②加入药品,加热,导管口有大量气泡生成。 ③收集气体。 ④停止加热。熄灭酒精灯前,应 ,目的是 。 |
(2)小明同学根据小华的实验判断该药品的成分是 。他又结合两物质的溶解性知识,设计了另一种实验方案,得到了同样的结论。其实验方案是 。
将碳酸钠和硫酸钠的固体混合物6g放入烧杯中,此时总质量为106g,加入24.5g硫酸,恰好完全反应(反应方程式为Na2CO3 + H2SO4 ="=" Na2SO4 + H2O +CO2↑),待没有气泡逸出后再次称量,总质量为 128.3g。计算所得溶液中溶质的质量分数(CO2的溶解忽略不计)
百花盛开,阵阵花香,沁人心脾。花香四溢的现象说明
| A.分子是不断运动的 | B.分子是由原子构成的 |
| C.分子具有一定的质量 | D.分子之间有一定的间隔 |
“神州七号”太空舱将利用NiFe2O4将航天员呼出的CO2转化为O2,而NiFe2O4的质量和化学性质都不改变,在该过程中NiFe2O4是
| A.反应物 | B.生成物 | C.催化剂 | D.消毒剂 |
下列事实与氧气的化学性质无关的是
| A.氧气可用向上排空气法收集 | B.氧气可以供给呼吸 |
| C.氧气能使带火星的木条复燃 | D.白磷能在空气中燃烧 |
科学家发明了一种“月球制氧机”,这种“月球制氧机”可利用聚焦太阳能产生的高温加热月球土壤,制得氧气。据此可推测月球土壤中一定含有
| A.氧化物 | B.氧元素 | C.氧气 | D.水 |
用如图所示的装置制取气体,需满足的条件是 
①反应物是固体 ②反应需要加热 ③制取的气体不易溶于水
④制取的气体密度比空气大 ⑤制取的气体能与空气中氧气反应。
| A.①②③ | B.②④⑤ | C.①②③④ | D.①② |
区别CO和CO2最简便的方法是
| A.测量它们的密度 | B.检验它们是否有毒 |
| C.分别通入到水中 | D.分别通入到澄清石灰水中 |
下列实验现象描述与事实不符合的是
| A.红磷在空气中燃烧产生大量白烟 |
| B.镁与稀盐酸反应产生气体,放出热量 |
| C.木炭在氧气中燃烧,发出白光,有黑色固体生成 |
| D.电解水时,与正极、负极相连的电极产生的气体体积比约为1∶2 |
下列化学用语中,正确的是
| A.两个氢分子 2H | B.氧化钠:NaO |
| C.2个硫酸根离子:2SO42- | D.+2价的镁元素:Mg2+ |
图1是元素周期表中铝元素的部分信息,图2是铝原子的结构示意图。下列说法不正确的是

| A.铝元素原子核内的质子数为13 |
| B.铝的相对原子质量为26.98 g |
| C.铝原子的核外电子分三层排布 |
| D.铝元素的化学性质与铝原子的最外层电子数有密切的关系 |
某河水中含有的物质R在氧气的作用下发生反应,其反应的化学方程式为
2R+2H2O+7O2 =" 2FeSO4+2H2" SO4,则R的化学式是
| A.FeS | B.FeS2 | C.FeO | D.Fe2S3 |
下列实验操作中,“先”与“后”的顺序不正确的是
| A.制备气体时,先装药品,后检查装置的气密性 |
| B.用排水法收集完氧气,先把导管移离水面,后停止加热 |
| C.用量筒量取10mL液体时,先倒入接近10mL的液体,后用胶头滴管补至刻度线 |
| D.用托盘天平称量物质时,先加质量大的砝码,再加质量小的砝码,最后移动游码 |
鉴别下列各组物质的方法不正确的是
| 选项 |
鉴别的物质 |
鉴别的方法 |
| A |
纯水和矿泉水 |
观察是否澄清 |
| B |
二氧化碳和一氧化碳 |
点燃,观察是否能燃烧 |
| C |
水和过氧化氢溶液 |
加二氧化锰,观察是否有气泡 |
| D |
冰和干冰 |
室温(20℃)放置,过一段时间观察是否有液体残留 |
将一定量的稀硫酸加入到过量的锌粉中,右图是反应过程中某种物质的质量Y随着时间变化的关系,则Y不可能的是
| A.消耗锌粉的质量 | B.剩余稀硫酸的质量 |
| C.生成氢气的质量 | D.生成ZnSO4的质量 |
将一定量的木炭在盛有32g氧气的密闭容器中燃烧(氧气完全反应),将生成的气体通入足量的澄清石灰水中,生成50 g沉淀。生成气体中碳元素的质量分数为
| A.12% | B.24% | C.36% | D.50% |
下列氮气的性质中,属于化学性质的是
| A.没有气味 | B.难溶于水 |
| C.在一定条件下与氢气反应生成氨气 | D.常温下为无色气体 |
农作物常因缺钾、氮、磷等而导致生长不良,这里说的“钾、氮、磷”指的是
| A.元素 | B.分子 | C.单质 | D.混合物 |
天然气是重要的化石燃料,其主要成分的化学式为
| A.H2 | B.CO | C.CH4 | D.C2H5OH |
现在社会提倡“节能、环保、低碳”,下列做法中,不符合上述理念的是
| A.停止含碳矿物的开采和加工 |
| B.尽量减少含碳物质的排放和浪费 |
| C.在生产和生活中提倡使用节能技术和节能用具 |
| D.积极开发使用风能、太阳能等新能源,减少化石燃料的使用 |
温度升高时,温度计内的酒精柱会上升,从微观角度分析,其原因是
| A.酒精分子的体积变大 | B.酒精分子的数目增多 |
| C.酒精分子的运动减慢 | D.酒精分子之间的间隔增大 |
下列活动中,通过化学反应提供能量的是
 |
 |
 |
 |
| A.发射航天飞机 | B.水车汲水灌溉 | C.太阳能供热 | D.风力发电 |
一种“环保石头纸”在2010年的两会上以便签、文件袋等形式首次亮相。“环保石头纸”的主要原料是碳酸钙和高分子材料。“环保石头纸”属于
| A.单质 | B.化合物 | C.纯净物 | D.混合物 |
英国科技人员研制出自动灭火陶瓷砖,即在砖里压入了一定量的氦气和二氧化碳。这种砖砌成的房屋发生火灾时,在高温烘烧下,砖会裂开并喷出氦气和二氧化碳,从而抑制和扑灭火焰。自动灭火陶瓷砖的灭火原理是
| A.清除可燃物 | B.使可燃物与氧气隔绝 |
| C.降低可燃物的着火点 | D.使可燃物的温度降低到着火点以下 |
下列关于氧气的说法中,不正确的是
| A.氧气可用于炼钢 |
| B.氧气的化学性质比氮气活泼 |
| C.红热的细铁丝 在氧气中剧烈燃烧,生成黑色固体氧化铁 |
| D.食品包装袋中常用铁粉做保鲜剂,其目的是将氧气除去 |
区别空气、氧气和二氧化碳这三瓶无色气体最简单的方法是
| A.测三瓶气体的密度 | B.闻三瓶气体的气味 |
| C.分别倒入澄清石灰水 | D.将燃着的木条分别放入瓶中 |
下图是水的电解实验,该实验的主要目的是
| A.研究水分解产物的性质 | B.观察水分解的现象 |
| C.验证水由氢元素和氧元素组成 | D.探究水分解的条件 |
印尼的默拉皮火山于2010年10至11月接连喷发,释放出大量的SO2气体。下列关于SO2的说法中,不正确的是
| A.SO2 是形成酸雨的一种气体 | B.SO2的相对分子质量为64 g |
| C.SO2分子由硫原子和氧原子构成 | D.SO2中硫元素的质量分数为50% |
3H2SO4中有“1”、“2”、“3”、“4”四个数字,它们表示的含义中,正确的是
| A.“1”表示硫元素的个数 | B.“2”表示一个氢分子中有两个氢原子 |
| C.“3”表示3个硫酸分子 | D.“4”表示4个氧原子 |
我国科学家在CO低温氧化的研究上取得了突破性进展。利用四氧化三钴纳米棒,可将汽车尾气中的CO在低温下与氧气反应转化为CO2,示意图如下。下列关于该转化的几点说法,不正确的是
| A.反应前后氧原子数不发生变化 |
| B.反应中CO与O2的质量比为7:4 |
| C.四氧化三钴纳米棒可能是反应的催化剂 |
| D.反应前后分子的数目没有发生改变,分子的种类发生了改变 |
资料:⑴ 2Na + C12 点燃 2NaCl ;⑵ 2Mg + CO2 点燃 2MgO + C。根据资料形成的以下几点认识中,正确的是
①反应(2)属于置换反应 ②二氧化碳一定不支持燃烧
③燃烧不一定要有氧气参与 ④氯化钠是由离子构成的物质
A.①③ B.①④ C.①②④ D.①③④
向a、b两支具支试管中加入形状和大小完全相同的铁片,再向a中加入植物油,分别塞上橡皮塞,U型玻璃管内为红墨水(开始时两端液面等高),如下图所示。放置一段时间后,下列叙述中,不正确的是
| A.两支试管中铁片均被锈蚀 |
| B.植物油的作用是隔绝氧气和水 |
| C.铁生锈的条件是与氧气和水同时接触 |
| D.U型玻璃管两端的液面变为左低右高 |
根据下表信息所得的四个结论中,不正确的是
| A.X是H2 | B.Y可能是氯元素由 |
| C.Z组成供给呼吸的单质是氧气 | D.W一定是碳元素 |
某品牌补钙药品的部分说明书如右图所示。若人体对该药品中钙的平均吸收率为30%,按照说明书服用,每天实际被人体吸收的钙元素质量为
| A.0.18 | B.0.36 | C.0.60 | D.1.20 |
水是人类生活中不可缺少的物质。
⑴下图①和②是两个简易净水装置。若对某河水水样进行初步净化:使用装置①时,应沿________慢慢向漏斗中倾倒河水,并注意液面始终要低于滤纸边缘;使用装置②时,活性炭的作用是___________(填序号)。
A.沉淀 B.过滤 C.吸附 D.使硬水软化
⑵下图③是自然界水的循环示意。针对水蒸发过程的几点说法中,正确的是______(填序号)。
A.符合质量守恒定律 B.水的化学性质保持不变
C.水分子没有发生改变 D.水的物理性质保持不变
① ② ③
⑶自来水消毒过程中常发生两个化学反应,其反应的微观过程可用下图表示。C与D的化学性质相比,稳定性强的是___________;D中氯元素的化合价为_____________
化学与生产、生活密切相关。
⑴高岭土是制造瓷器的一种主要原料,其主要成分是一种硅酸盐[化学式为Al2(Si2O5)(OH)4]。这种硅酸盐中含有的非金属元素有 种。
⑵夏天用来清凉散热、醒脑提神的清凉油主要成分为薄荷脑(化学式为C10H20O)。该物质中碳元素和氢元素的质量比为 。
⑶将辰砂和铁粉的混合物加热,生成了汞和硫化亚铁,由此推测辰砂中一定含元素 。
⑷“蜂窝煤”被加工成多孔形状的原因是 。制作“蜂窝煤”时常加入生石灰(主要成分为氧化钙),其燃烧过程发生的部分化学反应如下:①SO2 + CaO 高温 CaSO3,
②2CaSO3 + O2 高温 2CaSO4,③2SO2 + O2 高温 2SO3,④SO3 + CaO 高温 CaSO4。上述反应属于 反应(填基本反应类型);制作“蜂窝煤”时加入生石灰的作用 。
根据下图回答问题。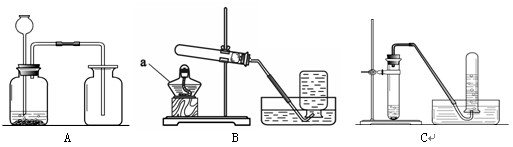
⑴仪器a的名称为 ▲ 。
⑵加热高锰酸钾制取氧气的装置是 ▲ (填序号),反应的化学方程式为 ▲ 。
⑶根据CO2的性质分析,制备二氧化碳气体的装置选用A而不选用C的原因是 ▲ ,
检验二氧化碳已经收集满的方法是 ▲ 。
过氧化钠(化学式为Na2O2)能与CO2反应,化学方程式为2Na2O2 + 2CO2 =" 2Na2CO3" + O2↑,可用在呼吸面具中作为氧气来源。某实验小组欲用干燥的二氧化碳与过氧化钠反应收集一瓶氧气,实验装置如下图所示,请回答问题。
⑴实验室制取二氧化碳的化学方程式为 ▲ 。
⑵浓硫酸的作用是 ▲ 。
⑶若实验过程中发现澄清的石灰水变浑浊,其原因可能为 ▲ ,发生反应的化学方程式为
⑷氧气可用E装置收集,并用带火星的木条检验,这是利用了氧气的 ▲ 性质
已知某金属粉末中可能含有铁、铝、铜三种金属中的两种或三种,化学小组的同学对该粉末进行探究。
【提出猜想】
猜想一:该粉末由铜、铝组成; 猜想二:该粉末由铁、铝组成;
猜想三:该粉末由铁、铝、铜组成; 猜想四:该粉末由 ▲ 组成。
【查阅资料】铝与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气,反应的化学方程式为2Al + 2H2O + 2NaOH =" 2NaAlO2" + 3H2↑,铁和铜与氢氧化钠溶液均不发生反应。
【供选药品】稀盐酸、稀硫酸、氢氧化钠溶液、硫酸铜溶液、澄清石灰水、蒸馏水。
【进行实验】
| 实验目的 |
实验操作 |
实验现象 |
实验结论 |
| 证明粉末中是否含有 ▲ |
取一个小烧杯,加入适量的粉末,再向其中加入足量的 ▲ |
▲ |
猜想四成立; 实验中发生反应 的化学方程式为 ▲ |
| 证明粉末中是否含有 ▲ |
过滤,将得到的固体洗涤后放入小烧杯,再向其中加入足量的稀盐酸 |
▲ |
【反思与评价】若将原粉末中的铜全部回收,请写出实验过程 ▲ 。
氢化钙(CaH2)是一种重要的制氢剂,与水接触时发生反应的化学方程式为CaH2 + 2H2O =" Ca(OH)2" + 2H2↑。若制取10 g氢气,需要消耗多少氢化钙?










 粤公网安备 44130202000953号
粤公网安备 44130202000953号