市场出售的“热敷袋”,其主要成分是铁屑、炭粉、木屑与少量氯化钠、水等。它在使用之前需用塑料袋与空气隔绝。使用时开启塑料袋的小气孔,轻轻揉搓就会放出热量来。当使用完后还会发现有锈生成,依上述现象完成下列问题:
(1)“热敷袋”放出热量使铁发生了什么反应?
(2)炭粉的主要作用是什么?
(3)加入氯化钠的作用是什么?
(4)写出有关的电极反应与化学方程式来表明上述过程。
按下面配方浸液配方可制无泥皮蛋:NaOH 6g、NaCl 10g、Ca(OH)2 69g、茶叶 5g、水210mL(可浸泡4只鸡蛋)。配制浸液时,可以用生石灰和纯碱代替氢氧化钙和氢氧化钠。请用化学方程式说明理由。
化学科学中许多原理与我们的生活、生产以及其他科学中的道理是一致的。请用短线将A栏与B栏相互关联的两项连接起来。
| A栏 |
|
B栏 |
| 用纳米作为单位衡量微观粒子的大小 |
|
用110种元素符号组成的化学式,可表示数千万种物质 |
| 用26个英文字母组成上万个英文单词 |
|
用碳12原子质量的l/12作为标准衡量原子的相对质量 |
| 生产上用筛子筛出沙中的石子 |
|
元素包括氢元素、氧元素、碳元素等 |
| 水果包括苹果、梨、桃子、葡萄等 |
|
用过滤器滤出混在液体中的不溶性固体 |
单质、氧化物、酸、碱和盐之间的相互关系如下图所示:
请回答:Na和S分别属于单质中的什么类别?它们能发生上表中各个箭头表示的反应吗? 如能反应,写出相关反应的化学方程式。
固体发光材料是一种能将激发的能量转变为可见光的固体物质。在基质中掺入杂质,含量可达千分之几或百分之几,可调整发光效率、余辉及发光光谱。如在刚玉Al2O3基质中掺入0.05~1.0%的Cr3+及在Y2O3基质中掺入Eu3+等均可制成固体发光材料。
⑴推测Al2O3基质中掺入Cr3+的发光原理。
⑵Y2O3属立方晶系,将Y2O3的立方晶胞分为8个小立方体,Y在小立方体的面心和顶点,O位于小立方体内的四面体空隙,画出这样四个小立方体,指出Y和O的配位数。
锂电池由于其安全可靠的性能,体积小、质量轻、高效能及可逆等卓越品质被广泛应用于移动电话、笔记本电脑、数码相机等便携式电子器材中。下图为锂电池工作原理图,阴极材料由LiMO2(M=Co,Ni,V,Mn)构成,阳极材料由石墨构成,阴、阳两极之间用半透膜隔开,充电时锂离子由阴极向阳极迁移,放电时则相反,电池可表示为:
(-)Cn/LiClO4/LiMO2(+)
⑴写出锂电池充放电时的可逆电极反应。
⑵根据上图所示的LiMO2的尖晶石结构,写出氧的堆积方式,并指出Li和M占据何种空隙,画出以氧为顶点的一个晶胞。
⑶锂离子在阳极与石墨形成固体混合物,试推测并画出锂离子嵌入石墨的可能结构。
⑷早期的阳极材料用的是锂金属,试指出锂金属作阳极材料的不足,并说明还可以用什么物质替代石墨作阳极材料?
2009年10月1日,我国成功举办国庆六十年阅兵活动。其中阅兵仪式上9辆电动车与混合动力车等新能源车辆的亮相,展示了综合国力、国防科技发展水平。同时也说明能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
① 上述反应符合“原子经济”原则的是 _____(填“Ⅰ”或“Ⅱ”)。
② 下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1= -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2= -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH3= -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:  (3)某实验小组依据甲醇燃烧的反应原理,
(3)某实验小组依据甲醇燃烧的反应原理,
①设计如右图所示的电池装置。该电池正极的电极反应为
。
② 工作一段时间后,测得溶液的pH减小,
该电池总反应的化学方程式为
。
2005年5月29日7时15分,宜昌市远安县茅坪场镇洪家垭煤矿井下南三平掘进头发生一起瓦斯爆炸事故,造成3人死亡,8人受伤。事故发生时有22人在井下作业,其中11人安全撤离。国家针对小煤矿的“关井压产”曾多次发出整治通知,但由于近期煤炭价格上扬,加之乡镇煤矿的停产整顿会直接影响当地财政税收,致使一些小煤矿矿主置工人生命安全于不顾,暗中又恢复了生产。
(1)在煤炭的形成过程中会产生瓦斯。瓦斯的主要成分是甲烷。请写出瓦斯爆炸主要反应的化学方程式: 。
(2)爆炸后,坑境内CO气体含量达10%以上,引起人体CO中毒。现场抢救CO中毒者,应立即采取什么措施?
(3)你对此事有何看法?
为缓解能源危机,能源专家构想出了利用太阳能促使燃料循环的构想图: 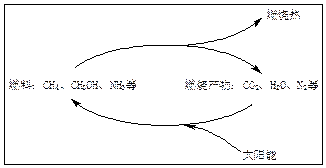
当前,科学家还未实现这一构想。但大自然已经解决了这个问题,绿色植物的光合作用就是在日光作用下,利用太阳能把CO2和H2O转变成了能源葡萄糖(可燃烧): 6CO2 + 6H2O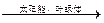 C6H12O6 + 6O2
C6H12O6 + 6O2
(1)如果上述构想成立,试写出有关反应的化学方程式。
(2)在此构想的物质循环中,太阳能最终转化为___________能。
(3)实现上述构想的关键问题是什么?
SO2是引起大气污染的主要有害气体之一,我国大气质量标准中规定大气中SO2的最高浓度限值如下表:大气中SO2三级标准浓度限值
| |
浓度限值[mg/(m3空气)] |
||
| 一级标准 |
二级标准 |
三级标准 |
|
| 年日平均 |
0.02 |
0.06 |
0.10 |
| 日平均 |
0.05 |
0.15 |
0.25 |
| 任何一次 |
0.15 |
0.50 |
0.70 |
注:“年日平均”为任何一年的平均浓度均值不许超过的限值;“日平均”为任何一日的平均浓度不许超过的限值;“任何一次”为任何一次采样测定不许超过的浓度限值。据报道,1952年2月,某城市雾大无风,家庭和工厂排出的烟雾经久不散,大气中SO2的含量高达3.8mg/(m3空气),烟尘达4.5mg/(m3空气),居民健康普遍受到危害,4天之内死亡人数约4000,流经该城市的主要河道也因此而受到污染,引起鱼类死亡。大气中的SO2将直接危害陆生高等植物的____组织,大气中SO2超标最容易影响人的_______系统而患疾病,而河流中鱼类死亡与SO2造成大气污染所形成______有关。
某空气污染监测仪是根据SO2和Br2水的定量反应来测定空气中的SO2含量的。反应的溴来自一个装有酸性(稀硫酸)的KBr溶液的电解池阳极的氧化反应,电解池的阳极室与阴极室是隔开的。当测量某地区空气中SO2的含量时,一天中作了三次取样监测,每次取样的空气(已除尘)都以1.5×10-4m3.min-1的流速进入电解池的阳极室,从电流计显示出每次的电流强度分别为8.56×10-6A、9.25×10-6A 、8.12×10-6A,每次都能够保持电解池中Br2浓度恒定并恰好与二氧化硫完全反应(设空气中不含与溴反应的其它杂质、1个电子电量为1.6×10-19C)。
写出此监测过程中发生反应的化学方程式。计算该地区空气中二氧化硫的含量有没有达到大气质量标准?当大气中SO2污染较严重时,目前有一种降低其危害的方法是用直升飞机喷撒白垩粉,其化学方程式为___________________。
某火力发电厂所在地有较丰富的碳酸钙矿和菱镁矿,若该发电厂以含硫重油作燃料,请就地取材提出三种化学反应原理与上一小题不同的“脱硫”方法(用化学方程式表示,):
第一种______________;第二种______________;第三种______________。某10 6 kW火力发电厂以重油为燃料。以含硫3.5%的重油为燃料,重油使用量为0.18 dm3.kW-1.h-1(重油的密度为0.95g.cm3)。该厂开工率(每年实际运转天数)为80%,对烟道气的脱硫效率为90%。问一年间对烟道气脱硫回收的SO2能生成多少吨石膏(CaSO4·2H2O)?
铅是一种重金属,相对原子量为207。铅和铅的化合物有很多用途,如蓄电池等,但铅类化合物大多有毒,燃煤厂、金属冶炼厂等都有主要的铅污染源。铅一旦进入人体会累积,对人脑、肾脏和造血功能有损害。为了了解环境中的铅污染问题,小红他同学进行了如下的研究。
1.在走访调查中,小红观察到某乡镇颜料厂排出的废水带有颜色,经鉴定含有铅。为了测定废水中铅的浓度,他设计了如下实验步骤
(1)步骤中过滤需要的玻璃仪器是、和玻璃棒。
(2)步骤中操作称为,缺少此操作,测得结果(填"偏高"、"偏低"、或"无影响")。
2.通过研究,小红提出了一系列降低铅对环境污染的建议,下列建议中不恰当的是
| A. | 使用无铅汽油 |
| B. | 开发新的无铅燃料 |
| C. | 倡导使用铅蓄电池作动力的电动车 |
| D. | 燃煤电厂、金属冶炼厂的废气经除尘后排放。 |