根据下面物质间转换的框图,回答有关问题:

(1)写出框图中物质A、D、F、G分别指代物质的化学式:
A. D. F. G.
(2)写出⑤反应的化学方程式 。
在⑤反应中当有6.6gD 足量的Na2O2参加反应时会造成固体增重 克 。
(3)写出④的离子反应方程式 。
由中学化学常见元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转化关系,A是由地壳中含量最多的金属元素组成的。请回答:
(1)写出下列物质的化学式:乙_______、丁_______、戊_______。
(2)写出甲物质在工业上的一种主要用途:_______。
(3)写出甲→乙+丙反应的离子方程式:____________,A→乙+C反应的化学方程式____________。
下表是A、B、C、D、E五种有机物的有关信息;
| A |
B |
C |
D |
E |
①能使溴的四氯化碳溶液褪色;②比例模型为: ,③能与水在一定条件下反应生成C ,③能与水在一定条件下反应生成C |
①由C、H两种元素组成;②球棍模型为: |
①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与E反应生成相对分子质量为100的酯. |
①相对分子质量比C少2;②能由C氧化而成; |
①由C、H、O三种元素组成;②球棍模型为: |
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称为 ;写出在一定条件下,A生成高分子化合物的化学反应方程式 。
(2)写出B在浓硫酸作用下,与浓硝酸反应的化学方程式 。
(3)C与E反应能生成相对分子质量为100的酯,其化学反应方程式为 。
(4)写出由C氧化生成D的化学反应方程式 。
已知有以下物质相互转化,其中A为常见金属, C为碱。试回答:
(1)写出E的化学式__________,H的化学式___________。
(2)写出由E转变成F的化学方程式:______________________。
(3)向G溶液加入A的有关离子反应方程式:__________________。
(4)写出A在一定条件下与水反应的化学方程式:___________________。
右图A→E是五种中学化学常见物质其中A、B、C、D常温下都是气体,B 为红棕色,A为气体单质。
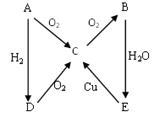
(1)写出化学式:B C
(2)实验室制备D实验中所用的干燥剂是: 。
(3)B与H2O反应,该反应的氧化剂和还原剂的物质的量之比为 。
(4)A与O2的反应方程式: ;D与O2的反应方程式:
;A与H2的反应方程式: 。
某化学小组用淀粉制取食品包装高分子材料B和具有果香味的物质D。其转化关系如下:

(1) C6H12O6名称是 ;A的电子式是 。
(2)写出下列反应方程式:
①淀粉一C6H12O6:
②C—D:
(3)写出常温下能与NaHCO3溶液反应的D的所有同分异构体的结构简式:
W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为 。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为 ;其水溶液中离子浓度由大到小的顺序是 。
(3)X的硝酸盐水溶液显 性,用离子方程式解释原因 。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 。
(5)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量。写出该反应的热化学方程式 。
乙醇经下列步骤反应合成化合物C(分子式为C4H8O2),已知C是环状化合物且不能使溴水、KMnO4(H+)溶液褪色,反应路线如下:

(1)写出A.C结构简式:A , C ;
(2)写出x、y的反应类型:x 、y 。
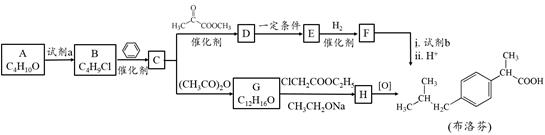
解热、镇痛药物布洛芬的两种合成路线如下:
已知: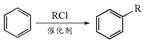 (R为烃基)
(R为烃基)
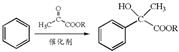 (R为烃基)
(R为烃基)
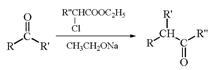 (R、R’、R’’为烃基或氢原子)
(R、R’、R’’为烃基或氢原子)
(1)A为醇,其核磁共振氢谱有四个吸收峰。A的结构简式是 。
(2)A与试剂a反应生成B的反应类型是 。
(3)由B生成C的化学方程式是 。
(4)D与E的相对分子质量相差18,由D生成E的化学反应方程式是 。
(5)G的结构简式是 ,H的含氧官能团的名称是 。
(6)布洛芬有多种同分异构体,写出满足下列条件的任意两种同分异构体的结构简式 。
a. 羧基与苯环直接相连 b. 苯环上有三个取代基,且苯环上的一氯代物有两种
化合物 是鞘氨醇激酶抑制剂,其合成路线如图:
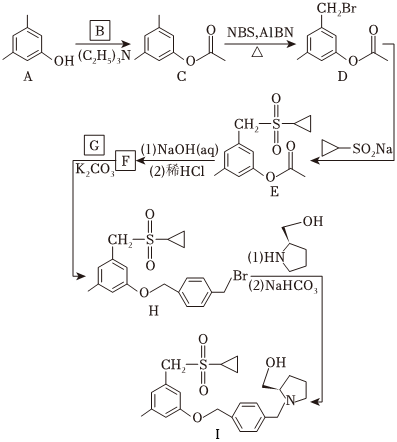
(1)化合物A的酸性比环己醇的_____(填“强”或“弱”或“无差别”)。
(2)B的分子式为 ,可由乙酸与 反应合成,B的结构简式为_____。
(3)A→C中加入 是为了结构反应中产生的_____(填化学式)。
(4)写出同时满足下列条件的C的一种同分异构体的结构简式:_____。碱性条件水解后酸化生成两种产物,产物之一的分子中碳原子轨道杂化类型相同且室温下不能使 酸性 溶液褪色;加热条件下,铜催化另一产物与氧气反应,所得有机产物的核磁共振氢谱中只有 个峰。
(5)G的分子式为 ,F→H的反应类型为_____。
(6)写出以 、
、 和
为原料制备
和
为原料制备 的合成路线流程图(须用
和
,无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(须用
和
,无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
我国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖。青蒿素的一种化学合成方法的部分工艺流程如图所示:



己知:①C6H5-表示苯基; ②
(1)化合物E中含有的含氧官能团有 、 和羰基(写名称)。
(2)1 mol化合物B最多可与_____________molH2发生加成反应。
(3)合成路线中设计E—→F、G-→H的目的是
(4)反应B→C,实际上可看作两步进行,依次发生的反应类型是 、_ __ _ 。
(5)A在Sn-p沸石作用下,可生成同分异构体异蒲勒醇,己知异蒲勒醇分子中有3个手性碳原子(连有四个不同基团的碳原子称为手性碳原子),异蒲勒醇分子内脱水后再与1分子H2发生1,4-加成可生成 则异蒲勒醇的结构简式为:
则异蒲勒醇的结构简式为:
(6)下图以乙烯为原料制备苄基乙醛 的合成路线流程图。
的合成路线流程图。

请填写下列空白(有机物写结构简式):
物质1为 ;物质2为 ;试剂X为 .条件3为 。
现有A、B、C、D、E五种原子序数依次增加的短周期元素,其中A的最低负价和最高正价代数和为零,且A2常温下为气态,B与其他元素形成的化合物种类最多,C与E可形成EC2和EC3两种物质,D是短周期最活泼的金属元素,用化学用语回答下列问题:
(1)D离子结构示意图_________________,B在元素周期表的位置_______________;
(2)A与C形成含18个电子的化合物的电子式是_______________;
(3)C与D形成的一种化合物颜色为淡黄色,其阴阳离子个数比为_____________,含有的化学键类型为___________;
(4)C、D、E的常见离子的离子半径由大到小的顺序__________________;
(5)B、E两元素得电子能力B________E(填“>”或“<”),试写出证明该结论的一个化学方程式_______;
(6)工业上常用氨水吸收尾气中的EC2,离子方程式为_______________________。
前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2。
(1)六种元素中第一电离能最小的是_____________(填元素符号,下同)
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式___ _,1molAB一中含有π键的数目为__ ______ (阿伏加德罗常数的值为NA),黄血盐晶体中各种微粒间的作用力不涉及____ (填序号)。
a .金属键. b.共价键 c.配位键 d.离子键 e.氢键 f.分子间的作用力
(3)E2+的价层电子排布图为 ,很多不饱和有机物在E催化下可与H2发生加成反应:如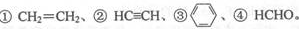 其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 ,它加成后产物甲醇的熔、沸点比CH4的熔、沸点高,其主要原因是 。
其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 ,它加成后产物甲醇的熔、沸点比CH4的熔、沸点高,其主要原因是 。
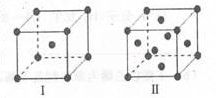
(4)金属C、F晶体的晶胞结构如图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为_ ___ 。金属C的晶胞中,若设该晶胞的密度为ag/cm3,阿伏加德罗常数的值为NA,C原子的摩尔质量为M g/mol,则表示C原子半径的计算式为 cm(不必化简)。
高分子材料E和含扑热息痛高分子药物的合成流程如下图所示:
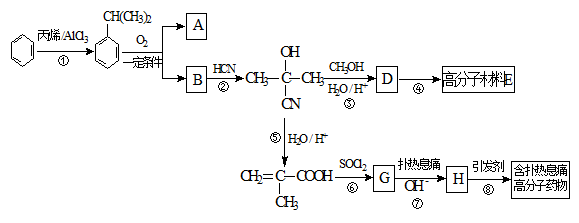
已知:I.含扑热息痛高分子药物的结构为: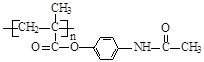 。
。
II.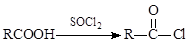
III.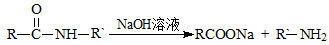
试回答下列问题:
(1)①的反应类型为____________,G的分子式为____________。
(2)若1 mol  可转化为1 mol A和1 mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式_____________。
可转化为1 mol A和1 mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式_____________。
(3)反应②为加成反应,则B的结构简式为__________;扑热息痛的结构简式为______________。
(4)写出含扑热息痛高分子药物与足量氢氧化钠溶液发生反应的化学方程式 。
(5)D蒸气密度是相同状态下甲烷密度的6.25倍,D中各元素的质量分数分别为碳60%,氢8%,氧32% 。D有多种同分异构体,其中属于链状酯类,且能发生银镜反应的同分异构体有_______种(考虑顺反异构)。
有机化学基础
(1)有A、B、C、D、E、F六种有机化合物,存在下图所示转化关系。已知A属于烃,且相对分子质量不超过30;在加热条件下,B可与氢氧化钠溶液反应,向反应后所得液中加入过量的硝酸,再加入硝酸银溶液,生成淡黄色沉淀。

①B中含有的官能团名称为 ;A可以在一定条件下聚合生成一种高聚物,该高聚物的名称是 。
②写出C和E反应生成F的化学反应方程式: 。
(2)一种炔抑制剂的合成路线如下:

①化合物A的核磁共振氢谱有 种峰。
②化合物C中含氧官能团的名称是 、 。
③ 鉴别化合物B和C最适宜的试剂是 。
④ A→B的反应类型是 。
⑤ B的同分异构体很多,写出一种符合下列条件的异构体的结构简式: 。
a.苯的衍生物 b.含有羧基和羟基 c.分子中无甲基