乙醇经下列步骤反应合成化合物C(分子式为C4H8O2),已知C是环状化合物且不能使溴水、KMnO4(H+)溶液褪色,反应路线如下:

(1)写出A.C结构简式:A , C ;
(2)写出x、y的反应类型:x 、y 。
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
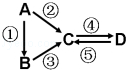
(1)若B是淡黄色固体,②③反应均用到同一种液态氢化物.D物质常用于食品工业.写出④反应的化学方程式 .
(2)若B是气态氢化物.C、D是氧化物且会造成光化学烟雾污染.写出③反应的化学方程式 .
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体.写出④反应离子方程式 .
(4)若A是太阳能电池用的光伏材料.C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性.写出②反应的化学方程式 .
(5)若A是应用最广泛的金属.④反应用到A,②⑤反应均用到同一种非金属单质.写出④反应的离子方程式 .
由中学化学常见元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转化关系,A是由地壳中含量最多的金属元素组成的。请回答:
(1)写出下列物质的化学式:乙_______、丁_______、戊_______。
(2)写出甲物质在工业上的一种主要用途:_______。
(3)写出甲→乙+丙反应的离子方程式:____________,A→乙+C反应的化学方程式____________。
已知有以下物质相互转化,其中A为常见金属, C为碱。试回答:
(1)写出E的化学式__________,H的化学式___________。
(2)写出由E转变成F的化学方程式:______________________。
(3)向G溶液加入A的有关离子反应方程式:__________________。
(4)写出A在一定条件下与水反应的化学方程式:___________________。
下表是A、B、C、D、E五种有机物的有关信息;
| A |
B |
C |
D |
E |
①能使溴的四氯化碳溶液褪色;②比例模型为: ,③能与水在一定条件下反应生成C ,③能与水在一定条件下反应生成C |
①由C、H两种元素组成;②球棍模型为: |
①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与E反应生成相对分子质量为100的酯. |
①相对分子质量比C少2;②能由C氧化而成; |
①由C、H、O三种元素组成;②球棍模型为: |
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称为 ;写出在一定条件下,A生成高分子化合物的化学反应方程式 。
(2)写出B在浓硫酸作用下,与浓硝酸反应的化学方程式 。
(3)C与E反应能生成相对分子质量为100的酯,其化学反应方程式为 。
(4)写出由C氧化生成D的化学反应方程式 。
某化学小组用淀粉制取食品包装高分子材料B和具有果香味的物质D。其转化关系如下:

(1) C6H12O6名称是 ;A的电子式是 。
(2)写出下列反应方程式:
①淀粉一C6H12O6:
②C—D:
(3)写出常温下能与NaHCO3溶液反应的D的所有同分异构体的结构简式:
某废金属屑中主要成分为Cu、Fe、Al,还含有少量的铜锈[Cu2(OH)2CO3]、少量的铁锈和少量的氧化铝,用上述废金属屑制取胆矾(CuSO4·5H2O)、无水AlCl3和铁红的过程如下图所示: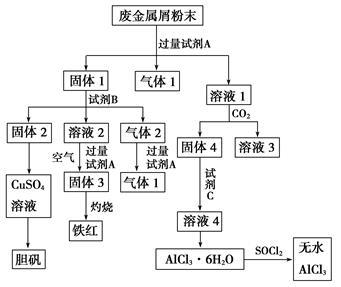
请回答:
(1)在废金属屑粉末中加入试剂A,生成气体1的反应的离子方程式是_________________。
(2)溶液2中含有的金属阳离子是__________;气体2的成分是______________。
(3)溶液2转化为固体3的反应的离子方程式是____________________________。
(4)利用固体2制取CuSO4溶液有多种方法。
①在固体2中加入浓H2SO4并加热,使固体2全部溶解得CuSO4溶液,反应的化学方程式是___________。
②在固体2中加入稀H2SO4后,通入O2并加热,使固体2全部溶解得CuSO4溶液,反应的离子方程式是_____________________________。
(5)溶液1转化为溶液4过程中,不在溶液1中直接加入试剂C,理由是__________________
(6)直接加热AlCl3·6H2O不能得到无水AlCl3。SOCl2为无色液体,极易与水反应生成HCl和一种具有漂白性的气体。AlCl3·6H2O与SOCl2混合加热制取无水AlCl3,反应的化学方程式是______________。
氯水具有多种性质,根据新制氯水分别与如图五种物质发生的反应填空(氯水足量):
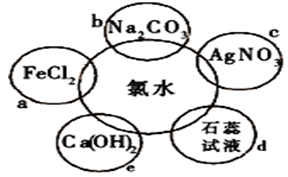
(1)a、b、c中反应的离子方程为_________________、___________、 _____________。e中的化学反应方程式______________,上述反应中发生了氧化还原反应的是: __________________ (填“a”、“b”、“c”或“e”)。
(2)能证明氯水具有漂白性的现象是 。
(3)久置的氯水变为______,用化学反应方程式表示为 。
(4)实验室保存饱和氯水的方法是_____ __。
(5)证明氯水与 a反应所需的试剂____ ___。
右图A→E是五种中学化学常见物质其中A、B、C、D常温下都是气体,B 为红棕色,A为气体单质。
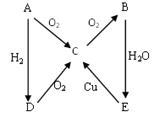
(1)写出化学式:B C
(2)实验室制备D实验中所用的干燥剂是: 。
(3)B与H2O反应,该反应的氧化剂和还原剂的物质的量之比为 。
(4)A与O2的反应方程式: ;D与O2的反应方程式:
;A与H2的反应方程式: 。
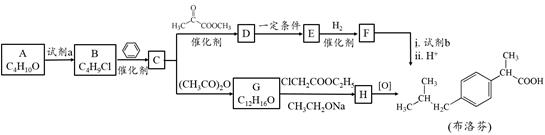
解热、镇痛药物布洛芬的两种合成路线如下:
已知: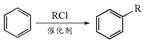 (R为烃基)
(R为烃基)
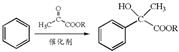 (R为烃基)
(R为烃基)
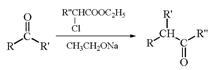 (R、R’、R’’为烃基或氢原子)
(R、R’、R’’为烃基或氢原子)
(1)A为醇,其核磁共振氢谱有四个吸收峰。A的结构简式是 。
(2)A与试剂a反应生成B的反应类型是 。
(3)由B生成C的化学方程式是 。
(4)D与E的相对分子质量相差18,由D生成E的化学反应方程式是 。
(5)G的结构简式是 ,H的含氧官能团的名称是 。
(6)布洛芬有多种同分异构体,写出满足下列条件的任意两种同分异构体的结构简式 。
a. 羧基与苯环直接相连 b. 苯环上有三个取代基,且苯环上的一氯代物有两种
(以下化学反应关系转化图中,A的焰色反应呈黄色,E、F为有刺激性气味的气体,F也是造成酸雨的主要成分,G为强酸性溶液,H为既难溶于水、也难溶于稀酸的白色固体。试回答:

(1)写出化学式:A ;B 。
(2)写出下列反应的化学方程式或离子方程式:
① C→E(化学方程式):
② D+E+H2O→H(化学方程式):
③ E+F+H2O→G(离子方程式):
(3)C溶液电解的另一气体产物的燃烧热为285.8kJ/mol,写出该物质燃烧的热化学方程式: 。
(4)将F气体通入品红溶液中的现象是 ,由此现象说明F气体具有的性质是 。
Hagemann酯的合成路线如下(部分反应条件略去):
(1)Hagemann酯的分子式为_____________。
(2)已知A→B、B→C均为加成反应,则B的结构简式是__________。
(3)E→F的化学方程式是_______________。
(4)已知Hagemann酯的一种同分异构体有下列结构特征:
①含有苯环且苯环上只有一个取代基;②除苯环外核磁共振氢谱吸收峰只有1个;③存在甲氧基(-OCH3)。则该同分异构体的结构简式为____________。
(5)下列说法正确的是________________。
①G为芳香族化合物
②A能和HCl加成得到聚氯乙烯的单体
③G与NaOH溶液共热,能得到甲醇
④在Ni催化下,1molHagemann酯最多能与2 mol H2发生加成反应
化合物F是合成抗过敏药孟鲁司特钠的重要中间体,其合成过程如下: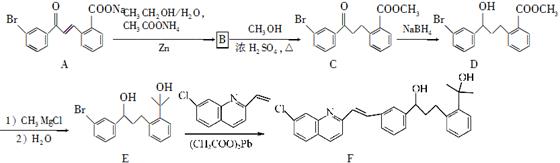
请回答下列问题:
(1)化合物C中含氧官能团为________、________(填名称)。
(2)化合物B的分子式为C16H13O3Br,则B的结构简式为____________。
(3)由C→D、E→F的反应类型依次为________、________。
(4)写出符合下列条件C的一种同分异构体的结构简式:______________。
Ⅰ.属于芳香族化合物,且分子中含有2个苯环;
Ⅱ.能够发生银镜反应;
Ⅲ.分子中有5种不同环境的氢原子。
(5)已知:RCl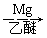 RMgCl,写出以CH3CH2OH、
RMgCl,写出以CH3CH2OH、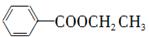 为原料制备
为原料制备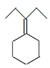 的合成路线流程图(乙醚溶剂及无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(乙醚溶剂及无机试剂任用)。合成路线流程图示例如下:
H2C=CH2 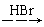 CH3CH2Br
CH3CH2Br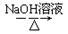 CH3CH2OH
CH3CH2OH
[有机化学基础]
某药物可通过以下方法合成:

注:非诺洛芬是一种治疗类风湿性关节炎的药物。请回答下列问题:
(1)非诺洛芬中的含氧官能团为 和 (填名称)。
(2)反应①中加入的试剂X的分子式为C8H8O2,X的结构简式为 。
(3)在上述五步反应中,属于取代反应的是 (填序号)。
(4)B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有6种不同化学环境的氢,且分子中含有两个苯环。
写出该同分异构体的结构简式: 。
(5)根据已有知识并结合相关信息,写出以 为原料制备
为原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:

M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
(1)元素Q的名称为____________,P的基态原子价层电子排布式为____________。
(2)O的氢化物的沸点比其上一周期同族元素的氢化物低,是因为______________。
(3)M、O电负性大小顺序是__________(用元素符号表示),O的最高价含氧酸根的空间构型为__________,其中心原子的杂化类型为__________。
(4)M、N形成的化合物的晶胞如图所示,该晶胞的化学式为__________,其中M离子的配位数为__________,该晶体类型为______________。
(5)该晶胞的边长为a×10-10cm,则距离最近的M、N离子间的距离为__________ 。