实验室需用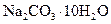 晶体配制
晶体配制 的
的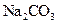 溶液,请回答下列问题。
溶液,请回答下列问题。
(1)应用托盘天平称取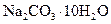 晶体_______g。
晶体_______g。
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上(1g以下使用游码),天平平衡时,实际称量的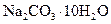 晶体是__________g。
晶体是__________g。
(3)本实验用到的主要仪器有:托盘天平、量筒、烧杯、玻璃棒、________、________。
(4)以下情况会使所配溶液的浓度产生何种影响(填“偏高”、“偏低”、“不变”。):
a.溶解晶体用的烧杯和玻璃棒未洗涤。____________
b.定容时俯视刻度线。____________
c.所用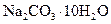 晶体已失去部分结晶水。____________
晶体已失去部分结晶水。____________
(5)若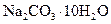 晶体中混有少量
晶体中混有少量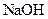 固体,且用所配制的
固体,且用所配制的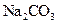 溶液与盐酸反应来测定某盐酸的物质的量浓度,所测盐酸的浓度会________。(填“偏高”、“偏低”、“不变”。)
溶液与盐酸反应来测定某盐酸的物质的量浓度,所测盐酸的浓度会________。(填“偏高”、“偏低”、“不变”。)
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H50H
②有关有机物的沸点:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点/℃ |
34.7 |
78.5 |
118 |
77.1 |
请回答:(1)浓硫酸的作用是 ;
写出合成乙酸乙酯的化学方程式:
(2)球形干燥管C的作用是 。
(3)饱和Na2CO3溶液的作用( )
A.中和乙酸和乙醇.
B.中和乙酸并吸收部分乙醇.
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出.
D.加速酯的生成,提高其产率.
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,
分离出 ;再加入(此空从下列选项中选择) ,然后进行蒸馏,收集77℃
左右的馏分,以得较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
为了检验和除去下表中的各种所含的杂质(括号里的物质),请从(I)中选出适当的
检验试剂,从(II)中选出适当的除杂试剂,将所选的答案的序号填入相应的空格内。
| 物 质 |
检验试剂 |
除杂试剂 |
| 甲烷(乙烯) |
|
|
| 酒 精(水) |
|
|
(I)检验的试剂:
| A.无水硫酸铜 | B.酸性高锰酸钾溶液 | C.盐酸 | D.氢氧化钠溶液 |
(II)除杂试剂:a.硫酸 b.乙酸 c.新制的生石灰 d.溴水
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H50H
②有关有机物的沸点:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点/℃ |
34.7 |
78.5 |
118 |
77.1 |
请回答:(1)浓硫酸的作用是 ;
写出合成乙酸乙酯的化学方程式:
(2)球形干燥管C的作用是 。
(3)饱和Na2CO3溶液的作用( )
A.中和乙酸和乙醇.
B.中和乙酸并吸收部分乙醇.
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出.
D.加速酯的生成,提高其产率.
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,
分离出 ;再加入(此空从下列选项中选择) ,然后进行蒸馏,收集77℃
左右的馏分,以得较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
为了检验和除去下表中的各种所含的杂质(括号里的物质),请从(I)中选出适当的
检验试剂,从(II)中选出适当的除杂试剂,将所选的答案的序号填入相应的空格内。
| 物 质 |
检验试剂 |
除杂试剂 |
| 甲烷(乙烯) |
|
|
| 酒 精(水) |
|
|
(I)检验的试剂:
| A.无水硫酸铜 | B.酸性高锰酸钾溶液 | C.盐酸 | D.氢氧化钠溶液 |
(II)除杂试剂:a.硫酸 b.乙酸 c.新制的生石灰 d.溴水
我校高二两个研究性学习小组用实验确定某酸HA是弱电解质。两组的方案:
甲:①称取一定质量的HA配制0.1mo1·L-1的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用的定量仪器是 。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填“>”“<”“=”)
乙方案中,说明HA是弱电解质的现象是 (多选扣分)
a.反应开始后装HCl溶液的试管中放出H2的速率快;
b.反应开始后装HA溶液的试管中放出H2的速率快;
c.两个试管中产生气体速率一样快。
(3)请你评价:乙方案中难以实现之处和不妥之处
。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作扼要表述。
聚合硫酸铁又称聚铁,化学式 ,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:
,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:
(1)验证固体W焙烧后产生的气体含有SO2的方法是 _________________________
(2)实验室制备,收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器口顺序为a _____
_____ _____
_____ _____
_____ _____
_____ f(填接口字母)。装置D的作用是__________。
f(填接口字母)。装置D的作用是__________。
(3)制备绿矾时,向溶液X中加入过量________,充分反应后,经过滤操作得溶液Y,再经浓缩,结晶 等步骤得到绿矾。
等步骤得到绿矾。
(4)若取m g制得的绿矾样品溶于水加入足量BaCl2溶液充分反应,过滤、洗涤、干燥,最终得n g BaSO4沉淀,则该绿矾含FeSO4·7H2O的质量分数为________(用含m、n代数式表示)。
(5)溶液Z的pH影响聚铁中铁的质量分数,要测定溶液Z的pH,除了需要溶液Z、pH试纸、表面皿、玻璃棒等仪器、药品外,还需要的一种仪器或药品是_____________________。若溶液Z的pH偏小,将导致 聚铁中铁的质量分数偏_____(大或小) 。
聚铁中铁的质量分数偏_____(大或小) 。
A~K为中学化学常见的物质,它们之间的转化关系如下图,部分生成物和反应条件等省略。已知C、D是由元素X、Y、Z中的两种组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色气体且不能燃烧,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板。请回答下列问题: 
1)写出A的化学式______________。
(2)比较Y与Z的原子半径大小:_________>_______(填写元素符号)。
(3)检验L溶液中金属阳离子的方法是__________________________________。
(4)已知F溶于稀硝酸,溶液变成蓝色,放出无色气体。请写出该反应的化学方程式
________________________________________________________
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好PH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
(1)请完成以下实验设计表(表中不要留空格)。
| 实验 编号 |
实验目的 |
T/K |
PH |
c/10-3mol·L-1 |
|
| H2O2 |
Fe2+ |
||||
| ① |
为以下实验作参考 |
298 |
3 |
6.0 |
0.30 |
| ② |
探究温度对降解反应速率的影响 |
|
|
|
|
| ③ |
|
298 |
10 |
6.0 |
0.30 |
[数据处理]实验测得p-CP的浓度随时间变化的关系如右上图。
(2)请根据右上图实验①曲线,计算降解反应在50~150s内的反应速率:
v(p-CP)=" ______________ " mol·L-1·s-1
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:___________________ 。
(4)实验③得出的结论是:pH等于10时,_________________________________。
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:
.。
我国规定饮用水质量标准必须符合下列要求:
| pH |
6.5~8.5 |
| Ca2+、Mg2+总浓度 |
<0.0045 mol·L-1 |
| 细菌总数 |
<100个·mL-1 |
以下是源水处理成自来水的工艺流程示意图:
(1)源水中含Ca2+、Mg2+、HCO-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式______________________。
(2)凝聚剂除去悬浮固体颗粒的过程是_____________(填写编号)
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4·7H2O是常用的凝聚剂,它在水中最终生成_____________沉淀。
(3)通入CO2的目的是____________________________和____________________。
(4)气体A的作用是____________________,这种作用是基于气体A和水反应的产物具有_______________________性。
(5)下列物质中,____________________可以作为气体A的代用品(填写编号,多选倒扣)。
①Ca(ClO)2 ②NH3 (l) ③K2FeO4 ④SO2
某固体混合物可能含有 、
、 、
、 、
、 、
、 和
和 。将该混合物进行如下实验,根据所给实验现象完成表格(对于能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”) :.
。将该混合物进行如下实验,根据所给实验现象完成表格(对于能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”) :.
(1)将少许混合物放入水中得到无色溶液和白色沉淀。
| 肯定存在的物质 |
肯定不存在的物质 |
理由 |
| |
|
|
(2)取溶液进行焰色反应,火焰呈黄色。
| 肯定存在的物质 |
肯定不存在的物质 |
理由 |
| |
|
|
(3)取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。
| 肯定存在的物质 |
肯定不存在的物质 |
理由 |
| |
|
|
(4)通过上述实验仍无法确定的物质是 。
下图是实验室制取Cl2并以Cl2为原料进行特定反应的实验: 
(1)A为氯气发生装置,写出反应的化学方程式________________________。
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C瓶后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl,写出D装置中反应的化学方程式 _____;装置C的作用是 。
(3)E处石蕊试液的现象是_______________;其原因是__________________。
(4)若将E处溶液改为石灰水,反应过程的现象是_____________________________。
A.有白色沉淀生成
B.无白色沉淀生成
C.先生成白色沉淀,然后沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此处B中的现象是________________,B的作用是________________。
[化学选修──有机化学基础]
根据图示回答下列问题: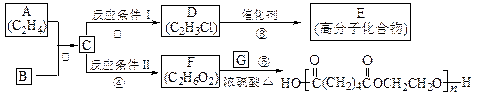
(1)写出A、E、G的结构简式:A_____________,E_______________,G______________;
(2)反应②的化学方程式(包括反应条件)是_________________________,
(3)反应④化学方程式(包括反应条件)是______________________ ______________;
(4)写出①、⑤的反应类型:①________________、⑤__________________。
为研究铁质材料与热浓硫酸的反应,某小组进行了以下探究活动:
[探究一]
(1)称取铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中是否含有Fe2+,应选择加入的试剂为____ (选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性KMnO4溶液
②乙同学取672 mL(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O=2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得到干燥固体4.66g。据此推知气体Y 中SO2的体积分数为____ 。(相对原子质量:O—16 S—32 Ba—137)
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体。为此设计了下列探究实验装置(图中夹持仪器省略)。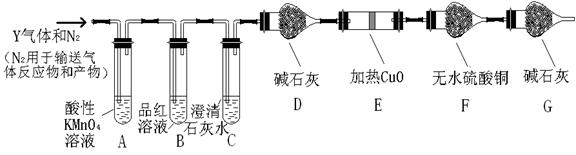
(2)写出产生CO2的化学方程式___ _。
(3)装置A中试剂的作用是____ 。
(4)简述确认气体Y中含有CO2的实验现象 。
(5)如果气体Y中含有H2,预计实验现象应是 。