某化学兴趣小组做了Na2CO3的相关性质实验,请按要求回答问题:
第一步:称量10.6g Na2CO3固体全部溶于水中,配成100mL溶液;
第二步:量取5.0mL上述溶液于试管中,再滴加2滴酚酞溶液,观察到的现象是 ,请说明原因 (用离子方程式表示);
第三步:将第二步试管中的溶液均分成2份,一份微微加热,观察到的现象是 ,请说明原因: (用文字说明);另一份慢慢滴加1.0 mol/L CaCl2溶液,观察到的现象是 ;
第四步:再量取4mL Na2CO3溶液于干净的试管中,缓慢滴加1.0mol/L HCl溶液2mL,滴加过程中始终没有观察到气泡产生,请说明原因 (用离子方程式表示)。
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 |
反应物 |
催化剂 |
| ① |
10 mL 2% H2O2溶液 |
无 |
| ② |
10 mL 5% H2O2溶液 |
无 |
| ③ |
10 mL 5% H2O2溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
| ④ |
10 mL 5% H2O2溶液+少量HCl溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
| ⑤ |
10 mL 5% H2O2溶液+少量NaOH溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是_______________________________。
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为_____________________。
(3)实验①和②的目的是______________________________。
实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_______________________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。
分析上图能够得出的实验结论是__________________________。
现有下列化学仪器与用品:①玻璃棒 ②烧杯 ③托盘天平 ④量筒 ⑤药匙 ⑥胶头滴管 ⑦容量瓶 ⑧标签纸 ⑨细口试剂瓶
Ⅰ.称量:若需要配制500 mL 0.622 moL / L NaOH溶液,则应称取固体NaOH g;
Ⅱ.用以上称量后的NaOH固体配制溶液并备用:按配制溶液的过程顺序,从上述所给仪器和用品中选取需要的仪器(重复的不计),其编号排列是 ;
Ⅲ.配制过程中,应将固体NaOH溶解后并冷却至室温的溶液转移到 中,在转移时玻璃棒起 作用;在液面接近容量瓶刻度线 处,改用 定容。
Ⅳ.若实验中遇到下列情况,可能导致溶液浓度偏高的是 (填字母):
| A.固体氢氧化钠溶解时未冷却至室温,就开始转移、洗涤以及定容; |
| B.转移时不小心有少量溶液流到了容量瓶外; |
| C.定容时仰视容量瓶刻度线; |
| D.定容时加水超过了刻度线,马上用胶头滴管吸去多余的水。 |
E、配制好后,发现称量时所用的托盘天平的砝码生锈了
硝酸是氧化性酸,其本质是NO3-有氧化性,某课外实验小组进行了下列有关NO3-氧化性的探究(实验均在通风橱中完成)。
(1)实验Ⅰ中,铝片作________(填“正”或“负”)极。液面上方产生红棕色气体的化学方程式是________。
(2)实验Ⅱ中电流计指针先偏向右边后偏向左边的原因是________。

查阅资料:活泼金属与1 mol·L-1稀硝酸反应有H2和NH4+生成,NH4+生成的原理是产生H2的过程中NO3-被还原。
(3)用上图装置进行实验Ⅲ:溶液X为1 mol·L-1稀硝酸溶液,观察到电流计指针向 右偏转。
① 反应后的溶液中含NH4+。实验室检验NH4+的方法是________。
② 生成NH4+的电极反应式是________。
(4)进一步探究碱性条件下NO3-的氧化性,进行实验Ⅳ:

① 观察到A中有NH3生成,B中无明显现象。A、B产生不同现象的解释是________。
②A中生成NH3的离子方程式是________。
(5)将铝粉加入到NaNO3溶液中无明显现象,结合实验Ⅲ和Ⅳ说明理由____________。
异丙苯( )氧化法是工业生产苯酚和丙酮最主要的方法。其反应和流程如下:
)氧化法是工业生产苯酚和丙酮最主要的方法。其反应和流程如下:
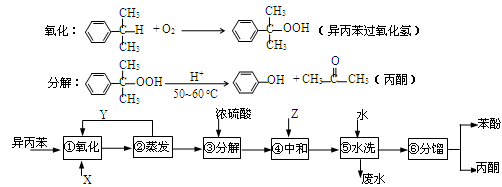
已知:
完成下列填空:
(1).X物质是 ;Y物质是 。
(2).浓硫酸的作用是 ,其优点是用量少,可能的缺点是 (写一条)。
(3).Z物质最适宜选择 (选填编号)。
a.NaOH b.Na2CO3 c.NaHCO3 d.CaCO3
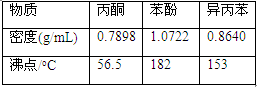
(4).步骤⑥分馏,工业上在分馏塔中进行,如右图,产品T是 ,请说明理由 。
废水中苯酚的含量,可根据苯酚与溴水的反应,用以下方法测定:
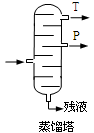
①把20.00mL废水、20mLKBrO3和KBr混合溶液[其中:
c(KBrO3)=0.0100mol/L,c(KBr)=0.0600mol/L]置于锥形瓶中,再加入10mL6mol/L的盐酸,迅速盖好盖子,摇动锥形瓶。
②充分反应后,稍松开瓶塞,从瓶塞和瓶壁间缝隙迅速加入10%KI溶液10mL(过量),迅速加盖,充分摇匀。加入少许淀粉溶液。
③用0.0250 mol/LNa2S2O3标准溶液滴定至终点。用去Na2S2O3溶液22.48mL。
(5).已知:BrO3–+5Br–+6H+→3Br2 + 3H2O ;写出苯酚与浓溴水反应的化学方程式 ;
第①步加盐酸、第②步加KI溶液,要迅速盖好盖子的原因是 。
(6).已知:I2 + 2Na2S2O3→2NaI + Na2S4O6;滴定终点的现象是 ;该废水中苯酚的浓度是 mol/L(保留4位小数)。
实验小组为探究SO2的漂白性和还原性,设计了以下实验。
完成下列填空:
(1).实验室用亚硫酸钠粉末跟硫酸制取二氧化硫,有下列三种硫酸溶液,应选用 (选填编号),其理由是 。
a.98%浓硫酸 b.70%硫酸 c.10%稀硫酸
І.漂白性
(2).用如图所示装置(气密性良好)进行实 验,观察到如下现象:ⅰ中红色褪去、

ⅱ中无变化。
①足量碱石灰的作用是 。
②从实验中可知使品红的水溶液褪色的 微粒可能是 。
(3).实验小组进一步实验如下:取等量相同浓度
的品红水溶液于两支试管中,再分别加入少量Na2SO3固体和NaHSO3固体,两支试管中的品红都褪色,于是得出结论:使品红褪色的微粒肯定是HSO3–或SO32–。你认为这一结论是否正确 ,理由是 。
ІІ.还原性
(4).将SO2通入FeCl3溶液中,使其充分反应。
①SO2与FeCl3反应的离子方程式是 ,如何检验该反应所得含氧酸根离子 。
②实验中观察到溶液由黄色变为红棕色,静置一段时间,变为浅绿色。
已知:红棕色为FeSO3(墨绿色难溶物)与FeCl3溶液形成的混合色;Fe3+可氧化SO32–。
则②中红棕色变为浅绿色的原因是 。
毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2.2H2O的流程如下:

(1)写出“浸取”环节发生的主要反应的离子方程式:____ 。实验室用37%的盐配置15%的盐酸,除量筒外还需使用下列仪器中的__________。
a.烧杯 b.容量瓶 c.滴定管 d.玻璃棒
(2)下图是一些难溶氢氧化物在不同pH下的沉淀一溶解图

①滤渣I中含 (填化学式)。再加入NaOH调节pH =12.5可除去_____________(填离子符号)。
②加入H2C204应避免过量的原因是_____________。
(3)25℃,H2C204和HF两种酸的电离平衡常数如下:

①HC2O4-的电离平衡常数表达式Ka2=________。
②H2C2O4溶液和NaF溶液反应的离子方程式为__________
FeSO4.7H2O俗称“绿矾”,是一种蓝绿色晶体。某课外活动小组同学在实验室发现一瓶绿矾已部分变质,拟用该试剂为原料,重新制取FeSO4.7H2O晶体,并测定其纯度。
【查阅资料】
①绿矾化学性质常不稳定,在潮湿空气中逐渐氧化变质,久置的绿矾溶液逐渐变为黄色,并出现棕黄色浑浊;
②硫酸亚铁的溶解度随温度升高而增大。
【制备晶体】
①取一定量已变质的“绿矾”于烧杯中,加适量水,搅拌,得到棕黄色悬浊液。
②加入一定量稀H2SO4和过量铁屑,在60℃左右水浴中加热,充分反应,待溶液完全变为浅绿色为止。
③趁热过滤,并用少量热水洗涤,将滤液转入到密闭容器中,静置、冷却结晶。
④待结晶完毕后,过滤出晶体,用少量冰水洗涤,再用滤纸吸干水分,最后放人广口瓶中密闭保存。
请回答下列问题:
(1)完成久置绿矾溶液在空气中变质反应的离子方程式:

(2)实验步骤②中加入稀硫酸的目的是_____________
(3)实验步骤③中趁热过滤目的是_____________
(4)实验中两次用到过滤操作,完成该操作的玻璃仪器有烧杯、 。
【测定纯度】
有同学认为,制备过程中可能有少量Fe2+被氧化为Fe3+,导致产品不纯。他们设计了如下方案测定产品的纯度。

请回答下列问题:
限选试剂:NaOH溶液、KSCN溶液、H2O2溶液、苯酚稀溶液、K3[Fe(CN)6]溶液、BaCl2溶液
(5)检验产品中是否含有Fe3+的无机试剂最好是:_____________。
(6)试剂X是:_____________。
(7)产品中FeSO4.7H2O(摩尔质量为278 g/mol)的含量为:_____________(用质量分数表示)。
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。在实验室里按下图所示装置,可进行模拟实验证明Na2O2的供氧作用。

(1)A中发生反应的离子方程式是 。
(2)填写表中空格。
| 仪器 |
加入试剂 |
加入该试剂的目的 |
| B |
饱和NaHCO3溶液 |
|
| D |
|
|
(3)试管F中收集满气体后,验证该气体的实验操作方法是 。
(4)C中反应的化学方程式是 。
某研究性学习小组欲由硫铁矿烧渣(主要成分为Fe、Fe2O3、SiO2、Al2O3 )制备绿矾(FeSO4·7H2O),流程图如下:
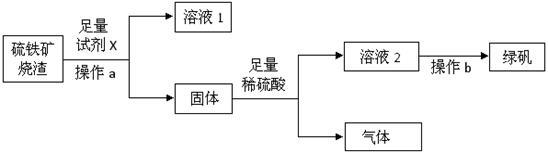
(1)操作a的名称是 。
(2)加入足量试剂X后,发生反应的离子方程式为 、 。
(3)若向溶液2中滴加KSCN溶液,无明显现象。固体与足量稀硫酸发生反应的离子方程式是 、 、 。
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。

(1)小组同学在实验时,当打开A的分液漏斗的下面活塞后,发现漏斗内的液体未流下,其原因可能是 。
(2)配平装置E中反应的化学化学方程式:
MnO2 + HCl(浓) MnCl2 + +
MnCl2 + +
(3)A、E均开始反应,当观察到B、D中的品红溶液均已褪色时,停止反应通气。取下B、D两个试管,分别加热,出现的现象是 。
(4)当小组同学将SO2和Cl2按体积比1:1,同时通入到品红溶液时,观察到品红溶液几乎没有出现褪色现象,分析其原因可能是(用化学用语表示) 。
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是
| A.上下移动①中铜丝可控制生成SO2的量 |
| B.②中选用品红溶液验证SO2的生成 |
| C.③中选用NaOH溶液吸收多余的SO2 |
| D.该反应中浓硫酸体现了强氧化性和脱水性 |
(1)某课外小组设计的实验室制取乙酸乙酯的装置如下图所示,A中盛有浓硫酸,B中盛有乙醇、乙酸,D中盛有饱和碳酸钠溶液。

请回答:
① 乙醇与乙酸制取乙酸乙酯的反应类型是 。
② 若用18O标记乙醇中的氧原子,则CH3CH218OH与乙酸反应的化学方程式是 。
③ 球形干燥管C的作用是 。
④ D中选用饱和碳酸钠溶液的原因是 。
⑤ 反应结束后D中的现象是 。
(2)下列叙述正确的是 (填字母)。
| A.向碘水中加入酒精,萃取碘水中的碘 |
| B.液化石油气、汽油和石蜡的主要成分都是碳氢化合物 |
| C.用淀粉水解液做银镜反应,若有银镜产生,则证明淀粉部分水解 |
| D.将无水乙醇和浓硫酸按体积比1∶3混合,加热至140℃制取乙烯 |
E.为证明溴乙烷中溴元素的存在,可向溴乙烷中加入NaOH溶液,加热;冷却后,加入稀硝酸至溶液呈酸性,滴入AgNO3溶液观察是否有淡黄色沉淀生成
为研究A的组成与结构,某同学进行了如下实验:
| 实 验 步 骤 |
实 验 结 论 |
| (1)将9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过足量的浓硫酸和碱石灰,发现两者分别增重5.4 g和13.2 g。 |
(1)A的实验式为 。 |
| (2)通过质谱法测得其相对分子质量为90。 |
(2)A的分子式为 。 |
| (3)另取9.0 g A,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况)。 |
(3)A中含有的官能团名称为 。 |
| (4)A的核磁共振氢谱有四组吸收峰,其峰面积之比为2︰2︰1︰1。 |
(4)综上所述,A的结构简式为 。 (5)写出A与NaHCO3反应的化学方程式 。 |
研究NO、NO2、SO2等大气污染气体的处理具有重要意义。
(1)以石灰石为原料通过系列反应将硫元素以CaSO4的形式固定,从而降低SO2的排放.但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4 (s)+CO (g)  CaO(s)+SO2 (g)+CO2 (g) △H=218.4kJ·mol-1(反应Ⅰ)
CaO(s)+SO2 (g)+CO2 (g) △H=218.4kJ·mol-1(反应Ⅰ)
CaSO4 (s) +4CO (g) CaS(s) +4CO2(g) △H2=﹣175.6kJ·mol-1 (反应Ⅱ)
CaS(s) +4CO2(g) △H2=﹣175.6kJ·mol-1 (反应Ⅱ)
结合反应Ⅰ、Ⅱ写出CaSO4 (s)与CaS (s) 反应的热化学反应方程式 。
(2)NO2、SO2气体混合存在氧化物间的相互转化平衡:
NO2(g)+SO2(g) SO3(g)+NO(g),某活动小组对此反应进行研究实验
SO3(g)+NO(g),某活动小组对此反应进行研究实验
| |
实验内容 |
实验现象 |
结论 |
| ① |
将充有NO2、SO2气体的密闭烧瓶放入热水中 |
气体红棕色加深,一段时间后颜色不再变化 |
△H 0(填“>”、“<”或“=”) |
| ② |
在针筒中抽入5mL NO2和5mL SO2气体,封闭针筒前端,充分反应后,将活塞迅速推至5mL处 |
气体红棕色加深并保持不变 |
平衡 (填“向左”、“向右”或“不”)移动 |
| ③ |
在充有NO2、SO2混合气体的恒容容器中,达平衡后继续通入SO2气体 |
|
平衡向右移动,SO2的转化率 (填“增大”、“减小”或“不变”) |
(3)工业上用活性炭还原法处理NO,有关反应为:C(s) +2NO(g) N2(g) +CO2(g)。
N2(g) +CO2(g)。
为了提高NO的转化率,下列的措施可行的是
A.再加入一定量的碳 B.增大压强
C.用碱液吸收气体 D.使用催化剂
(4)用间接电化学法除去NO的原理如图所示。已知电解池的阴极室中溶液呈酸性,阴极的电极反应式为 