(1)向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入一粒绿
豆大小的金属钠,观察到的现象正确的是________________。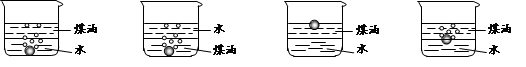
A B C D
(2)金属钠失火时,应该用 灭火。
(3)过氧化钠可用作潜水艇的供养剂,主要化学反应方程式为 。
(4)实验室盛放氢氧化钠溶液的试剂瓶不用玻璃塞,是因为玻璃中含 (填化学式),刻蚀玻璃常用的试剂是氢氟酸,发生反应的化学方程式为 。
(5)制取水泥和陶瓷的共同原料是 。
有关物质间转化关系如下图,试回答: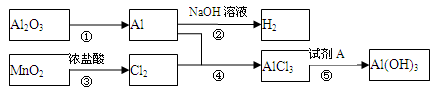
(1)转化①的反应条件为 .
(2)转化②的化学方程式为 .转化③的离子方程式为 .
(3)若转化⑤用于实验室制Al(OH)3,则试剂A宜选择 (填名称).
(4)向50 mL 3 mol·L-1 AlCl3溶液中滴加1 mol·L-1 NaOH溶液,结果Al3+离子有1/3转化为Al(OH) 3沉淀,则加入的NaOH溶液的体积可能为 mL。
在室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下列框图进行反应。又知E溶液是无色溶液。请回答:
(1)(用化学式填空)
A是______________B是________________
(2)反应①的化学方程式为___________________________________________
反应③的离子方程式为___________________________________________
反应⑤的化学方程式为___________________________________________________
浓硫酸在实验室可用来干燥Cl2、HCl等气体,这是利用了浓硫酸的__________性。 蔗糖遇浓硫酸变黑,是由于浓硫酸具有__________性。若将盛有浓硫酸的容器敞口放在空气中一段时间后, 其质量会__________(填“增加”、“减少”或“没有变化”)。
下列反应原理可以用于检查司机是否酒后开车。
K2Cr2O7+C2H5OH+H2SO4—Cr2(SO4)3+CH3COOH+K2SO4+
(1)在反应中,氧化剂是 。如果在反应中生成1molCr3+,转移电子数为 。(用NA表示阿伏加德罗常数)
(2)写出上述化学方程式所缺项(填化学式) 。
(3)乙醇(C2H5OH)和乙醚(CH3CH2OCH2CH3)的沸点分别是78.5℃、34.5℃,分离二者混合物的方法是 ,乙醇比乙醚的沸点高的原因是 。
硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下:
(1)步骤②中发生反应的离子方程式为 。
(2)步骤④中调节pH=6.0~6.5的目的是 。
(3)步骤⑤的操作为
(4)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH |
< 8.0 |
8.0 ~ 9.6 |
> 9.6 |
| 颜色 |
黄色 |
绿色 |
蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色
为 [25℃时,Ksp[Mg(OH)2] =5.6×10-12]。
氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40 ℃~50 ℃时
反应可生成它。CuH不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+ 在酸
性条件下发生的反应是2Cu+ =Cu2++Cu。根据以上信息,结合自己所掌握的化学知识,回答:
(1)在CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中所起的作用是________________。
(2)写出CuH在氯气中燃烧的化学反应方程式_______________________________。
(3)CuH溶解在稀盐酸中生成的气体是___________,如果反应中生成了标准状况下22.4 L的气体,被还原的离子得电子的物质的量是________________。
氯化铜是一种广泛用于生产颜料、用木材防腐剂的化工产品。某研究性学习小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体。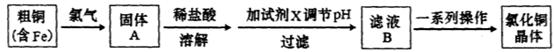
(1)固体A用稀盐酸溶解而不用水溶解的原因是________。
(2)加试剂X用于调节pH以除去杂质,X可选用下列试剂中的____(填序号)。
| A.NaOH | B.NH3.H2O | C.CuO | D.Cu(OH)2E. CuSO4 |
(3)滤液B经一系列操作可得氯化铜晶体,操作的程序依次为_________ 、_________、 过滤、自然干燥。
(4)实验室采用如下图所示装置,可使粗铜与Cl2反应转化为固体A(部分加热仪器和夹持装置已略去)。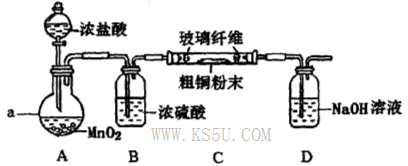
①该装置中仪器a的名称是____,其中发生反应的离子方程式是____________。
②有同学认为应在浓硫酸洗气瓶前增加吸收HCI的装置,你认为是否必要?____________(填“是”或“否”)。
③该装置存在一定的安全隐患,消除该安全隐患的措施是_______________________。
KClO3和浓HCl在一定温度下反应会生成黄绿色的易爆物二氧化氯。其反应可表述为:
KClO3+ HCl(浓)= KCl+ ClO2+ Cl2+ H2O
(1)配平以上化学方程式(化学计量数填入划线上)并用双线桥标出电子转移的方向和数目。
(2)反应中的氧化剂是 , ClO2是反应的 (填氧化或还原)产物。
(3)反应产生0.1 mol Cl2,则转移的电子的物质的量为 mol。
(4)ClO2具有很强的氧化性,因此可被用来做消毒剂,若ClO2作消毒剂后其自身转化为Cl-,则其消毒的效率(以单位物质的量得到电子数表示)是Cl2的 倍。
某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路,发生反应的化学方程式为: ①取少量废液,滴加KSCN溶液显红色.②取10mL废液,加入足量的AgNO3溶液,析出沉淀8.61g.③另取10mL废液,加入一定质量的铜片,充分反应后,测得铜片的质量减少了0.256g,再向反应后的溶液中滴加KSCN溶液不变色.根据探究实验得出结论:
(1)废液中含有的金属离子是 。
(2)求10mL废液中氯离子的物质的量浓度?
(3)求10mL废液中铜离子的物质的量是 ?
在用浓硫酸配制稀硫酸过程中,下列实验操作对所配制的稀硫酸的物质的量浓度有何影响?(在后面横线上“偏高”、“偏低”、“无影响”)。
I、用量筒量取浓硫酸时俯视凹液面
II、定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
Ⅲ、定容时仰视刻度线
Ⅳ、转移时容量瓶中有少量蒸馏水
为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。
(1)该组同学为了制取Cl2,SO2气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸(12mol/L)为原料制取Cl2。在此实验中,发生装置B应选择三种装置中的___________(选填序号),F的作用是_____________。
(2)D装置中主要反应的离子方程式为__________________________。
(3)为检验通入D装置中的Cl2是否过量,该组同学取适量D溶液滴加至盛有少量紫色石蕊的试管中,若出现___________现象,则Cl2过量,此时E中发生的离子反应方程式为______________________,若D中出现__________________实验现象,则氯气不过量。
A、B、C、D、E五种化合物,均含有前18号元素中某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。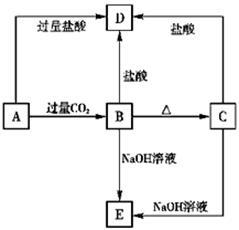
(1)写出化学式:A________,B________,C________,D________.
(2)写出下列反应的离子方程式:
B→D___________________,C→E_______________________
今有A.醋酸,B.盐酸, C.硫酸三种酸,请用三种酸的序号和“>”、“<”或“=”填空。
(1)在同体积,同pH的三种酸中,分别加入足量的NaHCO3粉末,在相同条件下产生CO2的体积由大到小的顺序是 。
(2)在同体积、同物质的量浓度的三种酸中,分别加入足量的NaHCO3粉末,在相同条件下产生CO2的体积由大到小的顺序是 。
(3)物质的量浓度均为0.1mol/L的三种酸溶液的pH由大到小的顺序是 ;如果取等体积的0.1mol/L的三种酸溶液,用0.1mol/L的NaOH中和,当恰好完全反应时,消耗NaOH溶液的体积由大到小的顺序是 。
Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为 。
(2)由A、B、W三种元素组成的18电子微粒的电子式为 。
(3)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式 。
(4)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,DA能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后成气全的体积是 (标准状况下)。
(5)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为 。
Ⅱ:X、Y、Z为三种不同短周期非金属元素的单质。在一定条件下发生如下反应:

(6)若常温下X、Y、Z均为气体,且A和B化合生成一种固体时的现象是有白烟,则:
Y的化学式是 ;生成固体的电子式为 。
(7)若常温下Y为固体,X、Z为气体,A 在空气中充分燃烧可生成B,B具有漂白性,则:将B与氯气的水溶液充分反应可生成两种强酸,该反应的化学方程式为_________________________。