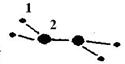
(1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示。测得M的摩尔质量为32g/mol。画出编号为2的原子结构示意图:。
(2)已知1.0mol·L—1NaHSO3溶液的pH为3.5,加入氯水,振荡后溶液pH迅速降低。溶液pH降低的原因是(用离子方程式表示)。
(3)在常温常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,生成1molNH3和O2时的能量变化值为382.5kJ,达到平衡后此反应NH3生成量与温度的实验数据如下表。则该反应的热化学方程式为。
T/K
|
303
|
313
|
323
|
NH3生成量/(10—1mol)
|
4.3
|
5.9
|
6.0
|
(4)在溶液中,一定浓度的NH4+能溶解部分Mg(OH)2固体,反应如下:
2NH4+(aq) + Mg(OH)2(s) 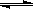 Mg2+(aq) +2NH3·H2O(aq)
Mg2+(aq) +2NH3·H2O(aq)
写出上述反应的平衡常数表达式
某研究性学习小组为探究Mg2+与NH3·H2O反应形成沉淀的情况,设计如下两组实验
实验①
|
等体积1 mol/L氨水和0.1 mol/L MgCl2溶液混合
|
生成白色沉淀
|
实验②
|
等体积0.1 mol/L氨水和1 mol/L MgCl2溶液混合
|
无现象
|
请分析实验①、②产生不同现象的原因:。
(5)在室温下,化学反应I—(aq)+ ClO—(aq)=IO—(aq) + Cl—(aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
实验编号
|
I—的初始浓度
(mol·L—1)
|
ClO—的初始浓度
(mol·L—1)
|
OH—的初始浓度
(mol·L—1)
|
初始速率v
(mol·L—1· s—1)
|
1
|
2 × 10—3
|
1.5 × 10—3
|
1.00
|
1.8 × 10—4
|
2
|
a
|
1.5 × 10—3
|
1.00
|
3.6 × 10—4
|
3
|
2 × 10—3
|
3 × 10—3
|
2.00
|
1.8 × 10—4
|
4
|
4 × 10—3
|
3 × 10—3
|
1.00
|
7.2 × 10—4
|
已知表中初始反应速率与有关离子浓度关系可以表示为v=" k" [I—]1 [ClO—]b [OH—]c(温度一定时,k为常数)。
①设计实验2和实验4的目的是;
②若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH = 13,反应的初始速率v=。

