某溶液 X 含有 H+、AL+、NH+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行实验,实验内容和相关数据(气体体积在标准状况下现定)如下:

(1)通过上述实验过程,一定不存在的离子是 。
(2)反应①中生成A的离子方程式为 。
(3)若测得X溶液中c(H+ )="5mol" • L-1,则X溶液中(填“含”或“不含”)Fe3+,c(Fe3+)="mol" •L—1 (若填不含,则不需计算),X溶液中c(C1- )= mol•L
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品,工业上常用铝土矿(主要成分为Al2O3和少量的SiO2、Fe2O3杂质)生产铵明矾晶体NH4Al(SO4)2•12H2O,其工艺流程图如下:

(1)废渣a、b 的成分分别是:_________、_____________。(写名称)
(2)流程图中X的化学式为:_______________。
(3)反应Ⅲ的离子方程式为:_________________________________________;从铵明矾溶液中获得铵明矾晶体的操作依次为(填操作名称)_________、冷却结晶、过滤洗涤。
(4)过硫酸铵[(NH4)2S2O8]在工业生产中有广泛的用途,可以作为氧化剂和漂白剂,广泛地用于蓄电池工业;还用作聚合的引发剂、纤维工业的脱浆剂。在上述的工艺流程中用惰性电极电解X与反应Ⅵ所得物质的混合溶液可以得到过硫酸铵。
写出阳极反应式:________________________ ____。
(5)反应Ⅶ的化学方程式为:_________________________ _____________;
NH4HSO4溶液中离子浓度由大到小顺序为:__________________________ _。
(6)向硫酸铝铵溶液中逐滴加入氢氧化钡溶液,不可能发生的反应是 (填选项字母)
| A.4NH4Al(SO4)2+3Ba(OH)2=2(NH4)2SO4+3BaSO4↓+ Al2 (SO4)3+2Al(OH)3↓ |
| B.2NH4Al(SO4)2+4Ba(OH)2=(NH4)2SO4+3BaSO4↓+Ba(AlO2)2 |
| C.2NH4Al(SO4)2+3Ba(OH)2=(NH4)2SO4+3BaSO4↓+2Al(OH)3↓ |
| D.NH4Al(SO4)2+2Ba(OH)2=NH3·H2O+2BaSO4↓+ Al(OH)3↓ |
(1)在一定温度下,向1L体积固定的密闭容器中加入1molA(g),发生反应2A(g) B(g)+C(g),B的物质的量随时间的变化如图所示。0—2min内的平均反应速率v(A)= . 相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时 是原来的2倍。
B(g)+C(g),B的物质的量随时间的变化如图所示。0—2min内的平均反应速率v(A)= . 相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时 是原来的2倍。
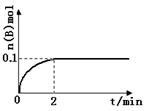
a.平衡常数 b.A的平衡浓度 c.达到平衡的时间
d.平衡时B的体积分数 e.平衡时混合气体的密度
f .平衡时混合气体的平均摩尔质量
(2)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若加入少量下列试剂中的 ,产生H2的速率
将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3 e. CH3COOH f.FeSO4
(3)用惰性电极电解Cu(NO3)2溶液一段时间后,加入a mol 的Cu(OH)2可使溶液恢复原状,则电解过程中转移的电子数目为_____________
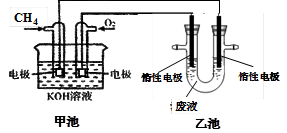
(4)氯化铁溶液常作印刷电路铜板的腐蚀剂,得 到含有Cu2+等的废液,有人提出可以利用如右图的装置从得到的废液中提炼金属铜。该过程中甲池负极的电极反应式是 ,若乙池中装入废液500mL,当阴极增重3.2g时,停止通电,此时阳极产生气体的体积(标准状况)为 (假设气体全部逸出)。
常温下,将0.01molNH4Cl和0.002molNaOH溶于水配成1L溶液,
(1)该溶液中存在的三个平衡体系是________________ 、
______________ ______、_____________________________。
(分别用化学用语表示,下同)
(2)溶液中共有 种不同的粒子。
(3)这些粒子中浓度为0.01mol/L的是 ,浓度为0.002mol/L的是 。
(4)物质的量之和为0.01mol的二种粒子是__________________________。
(5) 和 两种粒子数量之和比OH-多0.008mol
已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(成分主 要是Ni,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
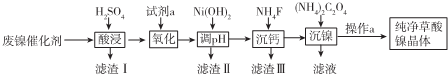
已知:①相关金属离子生成氢氧化物沉淀的pH如下表:
| 金属离子 |
Fe3+ |
Fe2+ |
Al3+ |
Ni2+ |
| 开始沉淀的pH |
1.1 |
5.8 |
3.0 |
6.8 |
| 完全沉淀的pH |
3.2 |
8.8 |
5.0 |
9.5 |
②Ksp(CaF2)=1.46×10-10
③当某物质模拟高度小于1.0×10-5mol.L-1时,视为完全沉淀.
(1)请写出一种能提高酸浸速率的措施________________________________。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式____________________。
(3)pH的调控范围为_____________,试用化学反应原理的相关知识解释滤渣Ⅱ的生成。
(4)写出“沉镍”时反应的离子方程式______,证明Ni2+已经沉淀完全的实验步骤及现象是________,
(5)操作a的内容为___________。
常温下,pH=1的某溶液A中含有NH4+、K+、Na+、Fe2+、Al3+、Fe3+、CO32-、NO3-、Cl-、I-、SO42-中的几种,现取该溶液进行有关实验,实验结果如下图所示:
回答下列问题:
(1)溶液A中一定不存在的阴离子有___________________
(2)生成沉淀甲和沉淀乙的离子方程式分别为___________________
(3)气体乙的结构式为_________________
(4)生成气体丙的离子方程式为__________________
若实验消耗Cu144g,则最多生成气体丁的体积(标准状况下)为__________。
【化学——选修3:物质结构与性质】
铁是最常见的金属材料。铁能形成 [Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等多种配合物。
(1)基态Fe3+的M层电子排布式为 ;
(2)尿素(H2NCONH2)分子中C、N原子的杂化方式分别是 、 ;
(3)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。 Fe(CO)x常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。
(4)常温条件下,铁的晶体采用如图所示的堆积方式。则这种堆积模型的配位数为 ,如果铁的原子半径为a cm,阿伏加德常数的值为NA,则此种铁单质的密度表达式为 g/cm3。
AX(g)+2X2(g) AX5(g)在容积为10L恒定不变的密闭容器中进行。起始时AX和X2均为1.3mol,分三组进行实验,每组只改变一个条件且改变条件均不同。反应体系总压强随时间的变化如图所示。(计算结果均保留两位有效数字)
AX5(g)在容积为10L恒定不变的密闭容器中进行。起始时AX和X2均为1.3mol,分三组进行实验,每组只改变一个条件且改变条件均不同。反应体系总压强随时间的变化如图所示。(计算结果均保留两位有效数字)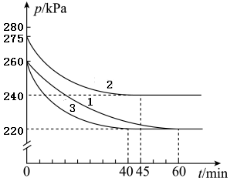
(1)计算实验1反应开始至达到平衡时的反应速率v(AX5)=________________。
(2)图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为______(填实验序号);
与实验1相比,其他两组改变的实验条件及判断依据是:2____________,3_________。
(3)用p1表示开始时总压强,p2表示平衡时总压强,α表示AX的平衡转化率,则α的表达式为____________;实验1和2的平衡转化率:α1为___________,α2为_________________。
(1)在室温时,NaHSO4溶液中c(H+) c(OH-)+ c(SO42-)(填 “>”、“=”或“<”),硫酸氢钠溶液与氢氧化钡溶液反应,若溶液中SO42-完全沉淀,则反应后溶液的pH 7(填 “>”、“=”或“<”)。
(2)将20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1 mol·L-1Na2CO3溶液中,溶液中发生反应的离子方程式为: ;向此反应后的溶液中滴加0.01 mol·L-1BaCl2溶液,首先析出的沉淀是 。[KSP(BaSO4)=1.1×10-10mol2·L-2;KSP(BaCO3)=5.1×10-9mol2·L-2]
室温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验 编号 |
HA的物质的量 浓度(mol/L) |
NaOH的物质的 量浓度(mol/L) |
混合后 溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=8 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?
(2)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=___________mol/L。
发射卫星用N2H4为燃料,NO2为氧化剂,两者反应生成N2和水蒸气,已知:
N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ/mol;
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ/mol;
2H2(g)+O2(g)===2H2O(g) ΔH3=-484 kJ/mol;
H2(g)+F2(g)===2HF(g) ΔH4=-538 kJ/mol
试写出N2H4与NO2反应的热化学方程式________________________________________。
写出N2H4与F2反应的热化学方程式___________________________________________。
(1)已知Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为10 mL):
| 实验编号 |
实验温度/℃ |
c(Na2S2O3)/ (mol·L-1) |
c(H2SO4)/ (mol·L-1) |
| ① |
25 |
0.1 |
0.1 |
| ② |
25 |
0.2 |
0.1 |
| ③ |
25 |
0.1 |
0.2 |
| ④ |
50 |
0.2 |
0.1 |
| ⑤ |
50 |
0.1 |
0.1 |
其他条件不变时:探究温度对化学反应速率的影响,应选择实验__________________(填实验编号);若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究______________________对化学反应速率的影响。
(2)已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久反应速率明显增大,溶液很快褪色。
针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是_______________________________的影响。
若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以选择在反应开始前是否加入________(填字母序号)做对比实验。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水
Ⅰ、NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是____________________________________________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1的NH4Al(SO4)2中c(NH)________(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH)。
(3)均为0.1 mol·L-1的几种电解质溶液的pH随温度变化的曲线如图所示。
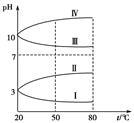
①其中符合0.1mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是________,导致pH随温度变化的原因是__________________________________;
②20℃时,0.1mol·L-1的NH4Al(SO4)2中2c(SO)-c(NH)-3c(Al3+)=________(取近似值)
(4)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:

试分析图中a、b、c、d四个点,水的电离程度最大的是________点;在b点,溶液中各离子浓度由大到小的排列顺序是_______________________________
Ⅱ、为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
| 操作步骤 |
现象 |
| 步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 |
出现白色沉淀。 |
| 步骤2:取1 mL上层清液于试管中,滴加1滴2mol·L-1 Fe(NO3)3溶液。 |
溶液变红色。 |
| 步骤3:向步骤2的溶液中,继续加入5滴3 mol·L-1 AgNO3溶液。 |
现象a,溶液红色变浅。 |
| 步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液。 |
出现黄色沉淀。 |
(1)写出步骤2中溶液变红色的离子方程式 。
(2)步骤3中现象a 。
(3)用化学平衡原理解释步骤4的实验现象
对含氮物质的研究和利用有着极为重要的意义。
(1)N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下:
N2(g)+O2(g)=2NO(g)  H=+180.5kJ·mol-1;
H=+180.5kJ·mol-1;
2H2(g)+O2(g)=2H2O(g)  H =-483.6 kJ·mol-1;
H =-483.6 kJ·mol-1;
N2(g)+3H2(g)=2NH3(g)  H =-92.4 kJ·mol-1。
H =-92.4 kJ·mol-1。
则氨的催化氧化反应的热化学方程式为 _。
(2)氨气是化工生产的主要原料之一,在一固定容积为2L的密闭容器内加入0.2 mol N2和0.5mol H2,发生如下反应: N2(g)+3H2(g) 2NH3(g) △H<0
2NH3(g) △H<0
①当反应进行到第5分钟时达到平衡,测得NH3的浓度为0.1mol/L 则从反应开始到平衡时,v(N2)为______________
②下列描述中能说明上述反应已达平衡的是
A.容器内的总压强不再随时间而变化
B.混合气体的密度不再随时间变化
C.a molN≡N键断裂的同时,有6amolN—H键生成
D.N2、H2、NH3的分子数之比为1∶3∶2
E.3V正(H2)=2V逆(NH3)
F.容器中气体的平均分子量不随时间而变化
③若保持反应温度不变,再向容器中充入N2和NH3各0.1mol , 则化学平衡将 移动(填“向左”、“向右”或“不”)
④平衡后,下列措施既能提高该反应的速率又能增大N2的转化率的是( )
A.充入N2 B.升高温度 C.向原容器内继续充一定量NH3 D.增大压强
⑤若保持容器体积不变,下列图像正确的是( )

Ⅰ、高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的
放电电压。高铁电池的总反应为
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
(1) 放电时正极附近溶液的碱性 (填增强、减小或不变);放电时每转移3 mol 电子,有 molK2FeO4被 (填氧化或还原)
(2)电池充电时阳极反应为
Ⅱ、下列框图中,A由两种黑色金属氧化物等物质的量混合而成,B中含有四种阳离子.据此回答下列问题:

(1)A的组成是(填化学式)
(2)相同条件下,溶液B中所有阳离子的氧化性由强到弱的顺序依次是
(3)A中某组分可由单质与水反应制得,化学方程式为:
(4)电解所用装置如右图所示
电解开始阶段,阳极上的电极反应是
电解至阴极刚开始有固体R析出时,该溶液中金属离子浓度由大到小的顺序是
