I:工业制硫酸时,利用接触氧化反应将SO 2转化为SO 3是一个关键步骤 。
(1)某温度下,2SO 2(g)+O 2(g) 2SO 3(g) △H="-197" kJ/mol。开始时在10 L的密闭容器中加入8.0 mol SO 2(g)和20.0 mol O 2(g),当反应达到平衡时共放出394kJ的热量,该温度下的平衡常数K= (保留两位有效数字),若升高温度时,K将 (填“增大、减小或不变”)。
2SO 3(g) △H="-197" kJ/mol。开始时在10 L的密闭容器中加入8.0 mol SO 2(g)和20.0 mol O 2(g),当反应达到平衡时共放出394kJ的热量,该温度下的平衡常数K= (保留两位有效数字),若升高温度时,K将 (填“增大、减小或不变”)。
(2)若体积不变的条件下,下列措施中有利于提高SO2的转化率条件是______(填字母)。
A.通入氧气 B.移出氧气 C.增大压强 D.减小压强 E.加入催化剂
(3)在硫酸工业生产过程中,有反应2SO2(g)+O2(g) 2SO3(g)(正反应为放热反应),根据下表提供的不同条件下SO2的转化率(%)的数据,试选择该反应的适宜条件(以V2O5作催化剂)温度____________;压强____________。
2SO3(g)(正反应为放热反应),根据下表提供的不同条件下SO2的转化率(%)的数据,试选择该反应的适宜条件(以V2O5作催化剂)温度____________;压强____________。

(4)能判断该反应达到平衡状态的依据是___________。
A. 容器的压强不变
B. 混合气体的密度不变
C. 混合气体中SO 3的浓度不变
D. C(SO 2)=C(SO 3)
E. v 正(SO 2)="v" 正(SO 3)
F. v 正(SO 3)="2v" 逆(O 2)
II:研究化学反应原理对于生产生活是很有意义的。
(1)在0.10mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________________mol·L-1(Ksp[Cu(OH)2]=2.2×10-20)。
(2)若在0.1mol·L-1硫酸铜溶液中通入H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是_______________mol·L-1。
(1)硼酸(H3BO3)溶液中存在如下反应:
H3BO3(aq)+H2O(l) [B(OH)4]-(aq)+H+(aq)。已知25℃时它的电离常数K=5.7×10-10。则此温度下0.7 mol·L-1硼酸溶液中H+的浓度= 。(计算结果保留小数点后一位)
[B(OH)4]-(aq)+H+(aq)。已知25℃时它的电离常数K=5.7×10-10。则此温度下0.7 mol·L-1硼酸溶液中H+的浓度= 。(计算结果保留小数点后一位)
(2)常温下,0.1 mol·L-1的氯化铵溶液pH=5.1.若常温下氨水的电离常数Kb=10-X,则x= 。
已知多元弱酸在水溶液中的电离是分步进行的,且第一步电离的程度远大于第二步电离的程度,第二步电离的程度远大于第三步电离的程度……
今有HA、H2B、H3C三种弱酸,根据“较强酸+较弱酸盐→较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:①HA+HC2-(少量)=A-+H2C-;②H2B(少量)+2A-=B2-+2HA;③H2B(少量)+H2C-=HB-+H3C。回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中酸性最强的是________。
(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子中最易结合质子的是__________,最难结合质子的是___________。
(3)下列离子方程式中正确的是________。
A.H3C+3A-=3HA+C3-
B.HB-+A-=HA+B2-
C.H3C+B2-=HB-+H2C-
(4)完成下列反应的离子方程式:
H3C+OH-(过量)→_________;
HA(过量)+C3-→__________。
氢气是一种理想的“绿色能源”,下图为氢能产生与利用的途径

(1)上图中4个过程中能量转化形式有_____________。
| A.2种 | B.3种 | C.4种 | D.4种以上 |
(2)电解过程要消耗大量电能,而使用微生物作催化剂在阳光下即可分解
以上反应的△H1_____________△H2 (选填“>"、“<”或“=”)。
(3)已知H2 O(1)→H2 O(g)△H=" +44" mol·L-1,依据右图能量变化写出氢气燃烧生成液态水的热化学方程式________________________________。
(4)氢能利用需要选择合适的储氢材料
①镧镍合金在一定条件下可吸收氢气形成氢化物:LaNi5(s)+3H2(g) LaNi5H6(s) △H<0,欲使LaNi5H6 (s)释放出气态氢,根据平衡移动原理,可改变的条件之一是___________。
LaNi5H6(s) △H<0,欲使LaNi5H6 (s)释放出气态氢,根据平衡移动原理,可改变的条件之一是___________。
②一定条件下,如图所示装置可实现有机物的电化学储氢,总反应:2C7 H8+6 H2O(1) 2C7 H14+3O2 (g) 电解过程中产生的气体X为_________,电极A发生的电极反应式为____________。
2C7 H14+3O2 (g) 电解过程中产生的气体X为_________,电极A发生的电极反应式为____________。
(1) 一定温度下,向1 L 0.l mol·L-1 CH3 COOH溶液中加入0.1 molCH3COONa固体,溶液中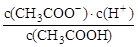 (填“增大”、“减小”或“不变”)。
(填“增大”、“减小”或“不变”)。
(2)常温下,将VmL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中,充分反应。回答下列问题。
①如果溶液pH=7,此时V的取值__ ___20.00(填“>”、“<”或“=”),而溶液中 c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为_____________________________。
②如果V=40.00,则此时溶液中c(OH-) -c(H+) - c(CH3COOH)= _________mol·L-1。
(3)常温下,向20 ml 0.1mol·L-1 Na2CO3溶液中逐滴加入0.1mol·L-1 HC1溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下图,回答下列问题:
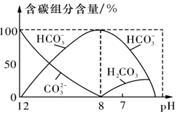
①若将Na2CO3和NaHCO3混合物配成溶液,
则此溶液的pH的取值范围是 ;
②为测定Na2CO3和NaHCO3混合物中的质量分 数,下列方案可行的是 。
| A.取a克混合物充分加热,减重b克 |
| B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 |
| C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 |
| D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 |
乙醇是重要的有机化工原料,可由乙烯直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H)。再水解生成乙醇。写出相应的反应的化学方程式 。
(2)已知:乙烯气相直接水合反应如下:
C2H4(g)+H2O(g)  C2H5OH(g) H=-45.5KJ/mol
C2H5OH(g) H=-45.5KJ/mol
下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中n(H2O):n(C2H4)=1:1)

①计算乙烯水合制乙醇反应在图中A点的平衡常数Kp= (Kp表示用平衡分压代替平衡浓度计算出的平衡常数的值,分压=总压×物质的量分数)
②图中压强P1、P2、P3、P4的大小顺序为: ,理由是 。
(3)若某温度下,反应C2H4(g)+H2O(g)  C2H5OH(g)的平衡常数为Kp=0.05MPa-1,体系总压为8.00MPa,各物质的量分数如下表所示。
C2H5OH(g)的平衡常数为Kp=0.05MPa-1,体系总压为8.00MPa,各物质的量分数如下表所示。
| 物质 |
C2H4(g) |
H2O(g) |
C2H5OH(g) |
| 物质的量分数 |
0.25 |
0.25 |
0.5 |
则v(正) v(逆)(填“>”“<”“=”)。
活性ZnO俗称锌白,能改进玻璃的化学稳定性,可用于生产特种玻璃。工业上由粗锌ZnO(含FeO、CuO等)制备ZnO,采取酸浸入、净化除杂、中和沉淀、干燥等步骤,工艺如下:

(1)该流程中物质X可以是下列中的 ( )
| A.ZnO | B.NaOH | C.Zn(OH)2 | D.Na2CO3 |
(2)已知ZnO为两性氧化物,与氢氧化钠溶液反应可生成可溶性的锌酸盐(ZnO22-),写出反应的离子方程式 ;
(3)写出加入H2O2时发生反应的离子方程式 ;
(4)加入Zn后,过滤所得的滤渣有 ;
(5)上述流程中多次用到了过滤操作,请写出过滤时用到的玻璃仪器: ;
(6)检验滤液A中溶质的阴离子的方法是 。
(7)取碱式碳酸锌水合物6.82g,溶于盐酸中生成二氧化碳448mL(标况下),溶解过程消耗氯化氢0.12摩尔,若该碱式盐中氢元素的质量分数为1.76%,试推测该碱是碳酸锌水合物的化学式是 。
如图装置中,容器甲内充入0.1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的9/10,随着CO2的继续通入,活塞又逐渐向右移动。(不考虑活塞的摩擦)

已知:2Na2O2+2CO2→2Na2CO3+O2
(1)已知当活塞移至C处时,干燥管中物质的质量增加了2.24g。
①此时,通入标准状况下的CO2气体为 L。
②容器甲中NO2转化为N2O4的转化率是 。
③活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处.则a值必 0.01(填大于、小于、等于),其理由是 。
(2)若改变干燥管中Na2O2的量,要通过调节甲容器的温度及通入的量CO2,使活塞发生从D到C,又从C到D的移动,则Na2O2的质量最小值应大于 g。
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计] 控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)
| 实验编号 |
实验目的 |
T/K |
pH |
c/10-3 mol·L-1 |
|
| H2O2 |
Fe2+ |
||||
| ① |
为以下实验作参照 |
298 |
3 |
6.0 |
0.30 |
| ② |
探究温度对降解反应速率的影响 |
|
3 |
|
|
| ③ |
|
298 |
10 |
6.0 |
0.30 |

[数据处理] 实验测得p-CP的浓度随时间变化的关系如上图
(2)请根据上图实验①曲线,计算降解反应50~150 s内的反应速率:
v(p-CP)=_______mol·L-1·s-1;
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大。但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:_____________;
(4)实验③得出的结论是:pH等于10时,反应 (填“能”或“不能”)进行;
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法: 。
汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)已知:2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=-746.5KJ/mol(条件为使用催化剂)
2CO2(g)+N2(g) △H=-746.5KJ/mol(条件为使用催化剂)
2C (s)+O2(g) 2CO(g) △H=-221.0KJ/mol
2CO(g) △H=-221.0KJ/mol
C (s)+O2(g) CO2(g) △H=-393.5KJ/mol
CO2(g) △H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g) △H= kJ·mol-1。
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| C(NO)10-4 mol/L |
10.0 |
4.50 |
C1 |
1.50 |
1.00 |
1.00 |
| C(CO)10-3 mol/L |
3.60 |
3.05 |
C2 |
2.75 |
2.70 |
2.70 |
则c1合理的数值为 (填字母标号)。
A.4.20 B.4.00 C.3.50 D.2.50
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:
| 实验 编号 |
T/°C |
NO初始浓 度/10-3mol•L-1 |
CO初始浓 度/10-3mol•L-1 |
催化剂的比 表面积/m2•g-1 |
| ① |
350 |
1.20 |
5.80 |
124 |
| ② |
280 |
1.20 |
5.80 |
124 |
| ③ |
280 |
1.20 |
5.80 |
82 |

则曲线I对应的实验编号为 。
(4)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
| H2O |
CO |
CO |
H2 |
|||
| ① |
650 |
2 |
4 |
2.4 |
1.6 |
5 |
| ② |
900 |
1 |
2 |
1.6 |
0.4 |
3 |
| ③ |
900 |
a |
b |
c |
d |
t |
①实验组①中以v(CO2)表示的反应速率为 。
②若a=2,b=1,则c= ,达平衡时实验组②中H2O(g)和实验组③中CO的转化率的关系为:α2 (H2O) α3 (CO)(填“<”、“>”或“=”)。
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。
①则负极的电极反应式为________________。

②以上述电池为电源,通过导线连接成图一。若X、Y为石墨,a为2L 0.1mol/L KCl溶液,写出电解总反应的离子方程式 。电解一段时间后,取25mL上述电解后的溶液,滴加0.4mol/L醋酸得到图二曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。根据图二计算,上述电解过程中消耗一氧化碳的质量为__________g。
(1)一定温度下,有a.盐酸;b.硫酸;c.醋酸三种酸,用字母填写下列空格:
①当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________________________。
②若三者c(H+)相同时,物质的量浓度由大到小的顺序是_________________________。
(2)常温下,0.1 mol·L-1的HCl溶液中,由水电离出来的H+浓度为________mol·L-1。
(3)在一元强碱MOH溶液中加入一元酸HA溶液,充分反应后,溶液呈中性。甲同学认为溶液中c(A-)=c(M+),而乙同学认为c(A-)和c(M+)是否相等,要看一元酸HA是强酸还是弱酸。你认为__________同学的说法正确,理由是____________________________。
(4)明矾[KAl(SO4)2·12H2O]常用作净水剂,其原理是_______________(用离子方程式表示)。
(5)将FeCl3溶液蒸干并灼烧,最终得到的固体物质是______________________(填写化学式)。
电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与右图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:

(1)若X、Y依次为铜和铁,a仍为CuSO4溶液,且反应过程中未生成Fe3+,则Y极的电极反应式为
(2)若用此装置电解精炼铜, 做阳极,电解液CuSO4的浓度 (填“增大”、“减小”或“不变”)。
(3)PbO2可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生反应的电极反应式为 ;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 。
(4)如图:A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。

比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为 (填字母序号)。
某无色溶液,只可能含有以下离子中的若干种:K+、Mg2+、Fe3+、NH4+、Cl﹣、CO32﹣和SO42﹣。现每次取100 mL进行实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH溶液,整个过程没有沉淀产生,加热,收集到气体1.12L(标准状况)
③第三份加入足量BaCl2溶液后得干燥沉淀4.30 g,沉淀经足量盐酸洗涤,干燥后剩余2.33g。
根据以上实验,肯定存在的离子有 ,肯定不存在的离子有 ,还有一种离子不能确定是否存在,要检验这种离子的实验操作方法是 。
【化学—选修2:化学与技术】煤炭被人们誉为黑色的“金子”,它是人类使用的主要能源之一。为了提高煤的利用率,减少有害气体的排放,人们采取了各式各样的方法。
(l)煤的气化和液化可以提高煤的利用率。煤的气化技术的主要产物是 。煤的液化技又分为 。将煤隔绝空气加强热得到焦炉气、煤焦油及焦炭等产品的技术称为
(2)煤在燃烧前后及燃烧过程中均可采取措施减少有害气体的排放
①在燃烧前,可以采用微生物脱硫技术。原理如图所示:

图示过程中Fe2+的作用为 写出 的离子方程式:
的离子方程式:
②煤在燃烧时,进行脱硫处理,常采用 燃烧技术,再把煤和脱硫剂加入锅炉燃烧室,使煤与空气在流化过程中充分混合、燃烧,起到固硫作用。常用脱硫剂的主要化学成分为 (填化学式)。
③煤在燃烧后,烟气净化常采用除尘技术和脱硫、脱硝技术。湿法脱硫、脱硝技术中将烟气通入
设备,用石灰水淋洗。
硫及其化合物有广泛应用。
(l)硫酸生产过程中涉及以下反应。已知25℃、10lkPa时:

则SO2催化氧化为SO3(g)的热化学方程式为
(2)对于SO2催化氧化为SO3的反应。
①图甲是SO2(g)和SO3(g)的浓度随时间t的变化情况。反应从开始到达到平衡时,用O2表示的平均反应速率为

②在一容积可变的密闭容器中充入20mol SO2(g)和10mol O2(g),O2的平衡转化率随温度(T)、压强(p)的变化如图乙所示。则p1与p2的大小关系是p1 p2:(填“>”“<”或“=”);A、B、C三点的平衡常数大小关系为 ( ),理由是
),理由是
(3)工业生产硫酸过程中,通常用氨水吸收尾气
①如果在25℃时,相同物质的量的SO2与NH3溶于水,发生反应的离子方程式为
所得溶液中 = (填序号)。
= (填序号)。

②已知在25℃时NH3·H2O、H2SO3电离平衡常数如下表,则上述所得溶液中,各离子浓度由大到小的顺序为
