Ⅰ.由苯乙烯制得的聚苯乙烯可用于制造一次性餐具。
(1)苯乙烯的分子式为_______________。
(2)苯乙烯制取聚苯乙烯的化学方程式为______________________。
Ⅱ.聚苯乙烯塑料性质稳定,会造成严重的“白色污染”。为此人们开发出一种聚乳酸塑料来替代聚苯乙烯。聚乳酸合成过程如下:
(3)淀粉和纤维素的分子式均可表示为(C6H10O5)n,下列关于淀粉和纤维素的说法正确的是( )
| A.互为同分异构体 | B.水解最终产物相同 |
| C.纤维素是纯净物 | D.均是高分子化合物 |
(4)乳酸分子中所含官能团有_________________(填名称)。
(5)根据结构推断聚乳酸可能发生的反应类型是______________,并据此说明用聚乳酸塑料替代聚苯乙烯塑料的好处是_____________。
(6)乳酸与足量Na反应的化学方程式为____________________。
海水提镁的工业流程如下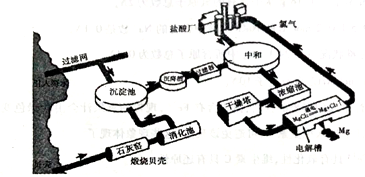
(1)煅烧贝壳时,贝壳的主要成分发生了什么变化?__________(用化学方程式表示)。
(2)从海水中的镁离子到金属镁,主要经历了三步化学变化,写出前两步反应的化学反应方程式:
①______________;②_______________。
③第三步反应(MgCl2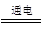 Mg+Cl2↑)中,每生成1molMg,转移的电子的数量是____________。
Mg+Cl2↑)中,每生成1molMg,转移的电子的数量是____________。
(3)在生产过程中采用了一些措施提高经济效益,请写出一点____________________。
(4)输送氯气的管道需要定期检查是否漏气,管道工人曾经用浓氨水检查氯气管道是否漏气。已知能发生如下反应(在有水蒸气存在的条件下):2NH3+3Cl2=N2+6HCl。下列说法中正确的是__________。
A.用该方法检验管道泄漏处会产生白烟
B.管道泄漏处会闻到刺激性气味
C.该反应中的HCl是氧化产物,N2是还原产物
盛放NaOH溶液的试剂瓶不能用玻璃塞,是为了防止发生反应(用离子方程式表示)________,避免瓶口与瓶塞粘在一起。
制造普通玻璃的主要原料是(写名称)_________、________、__________。
Cl2是一种有毒气体,如果泄漏会造成严重的危害。
(1)已知:3Cl2+8NH3 === 6NH4Cl+ N2,化工厂可用浓氨水来检验Cl2是否泄漏。当有少量Cl2泄漏,可以观察到的现象是 。
(2)喷射石灰乳等碱性物质可以减轻少量Cl2泄漏造成的危害。Cl2和石灰乳反应的化学方程式是 。
(3)实验室常用烧碱溶液吸收Cl2。若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液。当NaCl和NaClO3的物质的量之比为8︰1时,混合液中NaClO和NaClO3的物质的量之比为 。
阅读下面短文。
光的散射与丁达尔效应
光通过光学性质不均匀的介质时出现偏离原来传播方向,而沿侧向传播的现象,称为光的散射。在暗室里,将一束经聚集后的光线投射到胶体系统上,在与入射光垂直的方向上,可观察到一条明亮的光路,这就是丁达尔效应。产生丁达尔效应的实质是光的散射。
表1 分散系对可见光的不同作用
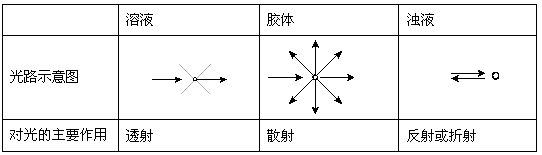
当入射光的波长略大于分散相粒子的直径时就发生光的散射。可见光的波长在400~760 nm的范围,略大于一般胶体粒子的直径(1~100 nm),因此当可见光束投射于胶体时,就发生光的散射,产生丁达尔效应。
对于溶液,分散质分子或离子更小,对可见光的散射作用很微弱;而当可见光束通过浊液时,由于分散质的粒子直径大于入射光的波长,主要发生反射或折射现象。
回答下列问题:
(1)产生丁达尔效应的实质是________________。
(2)制备Fe(OH)3胶体,在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入5~6滴饱和的_____________溶液,继续煮沸至液体呈红褐色即可。
(3)胶体区别于其他分散系的本质特征是________(填序号)。
a.胶体有丁达尔效应 b.胶体粒子可以透过滤纸
c.胶体的胶粒带有电荷 d.胶体粒子的直径在1~100 nm之间
(4)CuSO4溶液无明显丁达尔效应的原因是______________________。
某河道两旁有甲乙两厂,它们排放的工业废水中含有K+、Ag+、Fe3+、Cl—、OH—、NO3—六种杂质离子,甲厂的废水是无色透明的,乙厂的废水有明显的颜色。
(1)甲厂的废水中所含的三种离子是 。
(2)乙厂的废水有明显的 色
(3)将甲厂和乙厂的废水按适当的比例混合,可使废水中的 (填离子符号) 化为沉淀,过滤所得的废水中主要含 ,可用来浇灌农田。
有下列物品或设备:
①陶瓷餐具 ②砖瓦
③水泥路桥 ④门窗玻璃
⑤水晶镜片 ⑥石英钟表
⑦玛瑙手镯 ⑧硅太阳能电池
⑨光导纤维 ⑩计算机芯片
(1)用到硅单质的是______ _______。
(2)所用材料为SiO2或要用到SiO2的是_____ _______。
(3)所用材料为硅酸盐的是_____ _______。
已知:2X(g)+ Y(g) a Z(g),在T1温度下,体积为2L的密闭容器中,充入6mol X和2mol Y。根据图示回答:
a Z(g),在T1温度下,体积为2L的密闭容器中,充入6mol X和2mol Y。根据图示回答:

(1)a =________;用Y的浓度变化表示从反应开始到平衡时的平均反应速率为___________mol/(L•min)。
(2)平衡时,Y在混合物中的物质的量分数是___________。
(3)其他条件不变时,下列措施可以提高Y的转化率的是___________(选填字母)。
A.使用适当的催化剂 B.分离出Z C.增大容器体积
“西气东输”的气体是指天然气,主要成分是甲烷。工业上用碳与水在高温下反应制得水煤气。水煤气的主要成分是CO和H2,两者体积比约为1:1。1mol CO气体完全燃烧生成CO2气体放出283kJ热量,1molH2完全燃烧生成气态水放出242kJ热量;1molCH4气体完全燃烧生成CO2气体和气态水放出802kJ热量。
(1)写出H2完全燃烧生成气态水的热化学反应方程式:_________________________;
(2)忽略水煤气中其它成分,相同状况下若产生相等的热量,则所需水煤气体积是甲烷体积的________倍,水煤气放出CO2的体积是甲烷放出CO2的体积的__________倍。
(3)以天然气代替水煤气作民用燃料,突出的优点是__________和_________。(任写2点)
现有6种物质:①NaCl晶体 ②液态SO3 ③液态的醋酸 ④汞 ⑤BaSO4固体 ⑥酒精。 请用序号回答下列问题:
(1)属于强电解质的是______;(2)属于弱电解质的是__________;
(3)属于非电解质的是__________。
工业上用软锰矿(主要成分MnO2,杂质金属元素Fe、Al等) 制备MnSO4·H2O 的一种工艺流程如下:
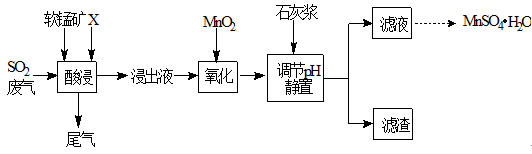
已知:
1.浸出过程中发生的主要反应化学方程式为:MnO2+SO2 =MnSO4
2.浸出液中阳离子主要有Mn2+、Fe2+、Al3+等
回答下列问题:
(1)物质X最好选用
a.盐酸 b.硫酸 c.硝酸
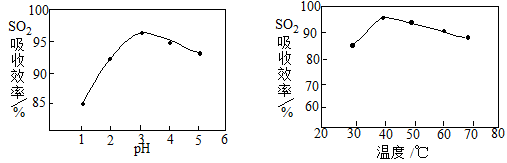
(2)酸浸时SO2的吸收效率与pH、温度的关系如下图所示,为提高SO2的吸收效率,酸浸适宜的条件是 。
(3) 流程中“氧化”步骤主要反应的离子方程式是 。
(4) 加入石灰浆调节pH,可将氧化后的浸出液中Fe3+、Al3+形成氢氧化物除去。检验Fe3+是否除尽的最佳方法是 。
(5) 用MnSO4可测定水中溶解氧,方法是:取100 mL 水样,迅速加入足量MnSO4溶液及含有NaOH的KI溶液,立即塞上塞子、振荡,使之充分反应;打开塞子,迅速加入适量的稀硫酸,此时有I2生成;再用5.00×10-3 mol·L-1 Na2S2O3溶液和I2反应,当消耗Na2S2O3溶液 12.0 mL时反应完全。有关化学反应方程式如下:
① 2Mn2++O2+4OH-=2MnO(OH)2(反应很快);
② MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;
③ I2+2S2O32-=S4O62-+2I-。
计算水样中溶解氧的浓度(以mg·L-1为单位),写出计算过程。
保护环境、保护地球是人类共同的呼声。
① “阅兵蓝”为2015年科技热词。较多排放下列气体不利于蓝天出现的是 (填字母)。
a.NO2 b.N2 c.CO2
② 天然水中含有的细小悬浮颗粒可用 (填字母)作混凝剂进行吸附沉降。
a.Cl2 b.KAl(SO4)2·12H2O c.NaClO
③ 工业废水中含有的Cr3+可用熟石灰作沉淀剂,在pH为8~9 时生成沉淀而除去,生成的沉淀化学式为 。
(2) 食品和药品关系人的生存和健康。
① 下列人体必需元素中,过多摄入 (填字母,下同)元素会引起甲状腺疾病,在牙膏中添加含 元素的化合物可以防治龋齿,儿童缺乏 元素会引发佝偻病。
a.碘 b.氟 c.钙 d.铜
② 下列是生活常用的物质:
a.碳酸氢钠 b.青霉素 c.葡萄糖 d.苯甲酸钠
e.柠檬黄 f.阿司匹林 g.维生素C
上述物质中可用作食品着色剂的是 (填字母,下同);可直接进入血液补充能量的是 ;可用作食品防腐剂的是 ;属于抗生素的是 。
(3) 材料是人类赖以生存和发展的重要物质基础。
① 下列属于复合材料的是 (填字母)。
a.有机玻璃 b.钢化玻璃 c.玻璃钢 d.石英玻璃
② 1928年美国杜邦公司首先合成了尼龙,由尼龙制成的尼龙丝耐磨、柔韧、有光泽,可作为丝绸的代替品,尼龙属于 (填字母)。
a.有机高分子材料 b.无机非金属材料 c.金属材料
③ 制造下列物质时,需要石灰石的是 (填字母)。
a.水泥 b.光导纤维 c.陶瓷
④ 钢铁是人类生产和生活中非常重要的材料,但每年因锈蚀而损失的数量十分惊人。铁器件在潮湿的空气中会发生 腐蚀(填“化学”或“电化学”),为防止铁质地下管道的腐蚀可在其表面附着 (填“锌块”或“石墨”)。
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
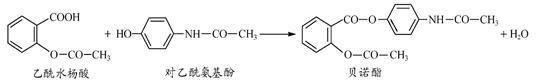
(1) 贝诺酯分子式为
(2) 对乙酰氨基酚在空气易变质,原因是 。
(3) 用浓溴水区别乙酰水杨酸和对乙酰氨基酚,方案是否可行 (填“可行”或“不可行”)。
(4)写出乙酰水杨酸与足量氢氧化钠溶液反应的化学方程式 。
(5)实验室可通过两步反应,实现由乙酰水杨酸制备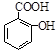 ,请写出两步反应中依次所加试剂的化学式 、 。
,请写出两步反应中依次所加试剂的化学式 、 。
用地壳中硅元素生产的多种产品在现代高科技中占重要位置,足见化学对现代物质文明的重要作用。例如:
(1)光导纤维的主要成分是 ;
(2)目前应用最多的太阳能电池的光电转化材料是 ;
(3)用作吸附剂、干燥剂、催化剂或催化剂载体的人造分子筛大多是一类具有均匀微孔结构的被称为 (物质类别)的化合物。
(4)赏心悦目的雕花玻璃是用一种物质对玻璃进行化学刻蚀而制成的,该反应的化学方程式为 ;
(5)工业上制取粗硅是用石英和焦炭在高温电炉中反应制得,该反应中氧化剂与还原剂的质量比为 ;用石英和焦炭在高温电炉中反应也可以制得金刚砂(SiC),并产生CO气体,该反应中氧化剂和还原剂的物质的量之比为 。