草酸(乙二酸)可做还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如图。

回答下列问题:
(1)CO和氢氧化钠在一定条件下合成甲酸钠的化学反应方程式为 。
(2)该制备工艺中有两次过滤操作,过滤操作②的滤液是 ,滤渣是 。
(3)工艺过程中③和④的目的是 。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸,该方案的缺点是产品不纯,其中含有的杂质主要是 。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定,称量草酸成品0.250g溶于水,用0.05000mol/L的酸性高锰酸钾溶液滴定,至浅红色不消退,消耗高锰酸钾溶液15.00mL,反应的离子方程式为 ;列式计算该成品的纯度 。
工业上可用以下方案使饮用水中NO3-含量达标。

请回答下列问题:
(1)调节pH不宜过大或过小,否则会造成Al的利用率降低;试剂X可选用________(填序号)。
A NaOH B Ca(OH)2 C NH3.H2O D CuO E CO2
(2)流程中操作①的名称为__________,若在实验室中进行此操作,所需要的玻璃仪器是___________。
(3)写出溶液中铝粉和NO3-反应的离子方程式:______________________。
(4)还可用以下化学反应使饮用水中NO3-含量达标,产物之一是空气的主要成分。完成下列离子方程式:

铁及其化合物有丰富多彩的化学性质。回答下列问题:
(1)铁元素在周期表中的位置为第___________周期第__________族。
(2) FeCl3溶液可用于吸收尾气中的SO2,写出该反应的离子方程式:_____________。
(3)某化学兴趣小组同学用下图装置,充分加热硫酸亚铁晶体(FeSO4.xH2O)至完全分解。
①装置A中需持续通入N2,其目的是
②充分反应一段时间后,小组同学观察到实验现象为:装置A中残留有红棕色固体,装置B中固体变蓝,C中溶液褪色,请写出FeSO4分解的化学方程式:________。
③装置D中干燥管的作用为__________。
④小组同学利用数字化实验仪器测定了不同温度时FeSO4.xH2O分解的质量变化情况,得到下
图关系:
实验结束后后,装置B质量增加12. 6g,结合上图数据,确定FeSO4·xH2O中的x=
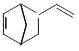 异构化可得到三元乙丙橡胶的第三单体
异构化可得到三元乙丙橡胶的第三单体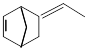 。
。 由A(C5H6)和B经Diels-Alder反应制得。Diels-Alder反应为共轭双烯与含有烯键或炔键的化合物相互作用生成六元环状化合物的反应,最简单的反应是
由A(C5H6)和B经Diels-Alder反应制得。Diels-Alder反应为共轭双烯与含有烯键或炔键的化合物相互作用生成六元环状化合物的反应,最简单的反应是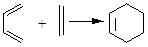 。
。
完成下列填空:
(1) Diels-Alder反应属于 反应(填反应类型):A的结构简式为 。
(2)写出与 互为同分异构,且一溴代物只有两种的芳香烃的名称 ,写出生成这两种一溴代物所需要的反应试剂和反应条件。
互为同分异构,且一溴代物只有两种的芳香烃的名称 ,写出生成这两种一溴代物所需要的反应试剂和反应条件。
(3)B与Cl2的1,2—加成产物消去HCl得到2—氯代二烯烃,该二烯烃和丙烯酸(CH2=CHCOOH)聚合得到的聚合物可改进氯丁橡胶的耐寒性和加工性能,写出该聚合物的结构简式。
(4)写出实验室由 的属于芳香烃的同分异构体的同系物制备
的属于芳香烃的同分异构体的同系物制备 的合成路线,(合成路线常用的表示方式为:
的合成路线,(合成路线常用的表示方式为: 目标产物)
目标产物)
2—丁烯是石油裂解的产物之一,回答下列问题:
(1)在催化剂作用下,2—丁烯与氢气反应的化学方程式为 ,反应类型为 。
(2)烯烃A是2—丁烯的一种同分异构体,它在催化剂作用下与氢气反应的产物不是正丁烷,则A的结构简式为 ;A分子中能够共平面的碳原子个数为 ,A与溴的四氯化碳溶液反应的化学方程式为 。
【化学——选修2:化学与技术】
工业上以Al(OH)3、H2SO4、(NH4)2SO4(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流程如图所示:

回答下列问题:
(1)氧化步骤中发生的主要反应的离子方程式为 。
(2)已知:25℃时,KW=1.0×10-14,Kb(NH3·H2O)=1.75×10-5。在(NH4)2SO4溶液中,存在如下平衡:
NH4++H2O NH3·H2O+H+,则该反应的平衡常数为 。
NH3·H2O+H+,则该反应的平衡常数为 。
(3)NH4Al(SO4)2溶液与过量NaOH溶液混合加热,反应的化学方程式为 。
(4)固体NH4Al(SO4)2·12H2O在加热时,固体残留率随温度的变化如图所示。633℃时剩余固体的成分为 。
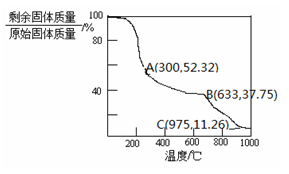
(5)综上分析,流程图中M混合气体的主要成分的化学式为 。M可用一种物质吸收以实现循环利用,该物质的名称是 。
下图所示的四个容器中分别盛有不同的溶液,除a、b外,其余电极均为石墨电极。甲为铅蓄电池,其工作原理为:Pb+PbO2+2H2SO4 2PbSO4+2H2O,其两个电极的电极材料分别为PbO2和Pb。闭合K,发现g电极附近的溶液先变红,20min后,将K断开,此时c、d两极上产生的气体体积相同;据此回答:
2PbSO4+2H2O,其两个电极的电极材料分别为PbO2和Pb。闭合K,发现g电极附近的溶液先变红,20min后,将K断开,此时c、d两极上产生的气体体积相同;据此回答:
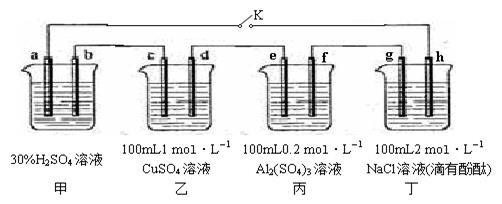
(1)a电极的电极材料是 (填“PbO2”或“Pb”)。
(2)丙装置中发生电解的总反应方程式为 。
(3)电解20min时,停止电解,此时要使乙中溶液恢复到原来的状态,需要加入的物质及其物质的量
是 。
(4)20min后将乙装置与其他装置断开,然后在c、d两极间连接上灵敏电流计,发现电流计指针偏转,则此时c电极为 极,d电极上发生反应的电极反应式为 。
(5)电解后取a mL丁装置中的溶液,向其中逐滴加入等物质的量浓度的CH3COOH溶液,当加入b mL CH3COOH溶液时,混合溶液的pH恰好等于7(体积变化忽略不计)。已知CH3COOH的电离平衡常数为1.75×10-5,则a/b = 。
V、W、X、Y、Z是由四种短周期元素中的两种或三种组成的5种化合物,其中W、X、Z均由两种元素组成,X是导致温室效应的主要气体,Z是天然气的主要成分,Y、W都既能与酸反应,又能与强碱溶液反应。上述5种化合物涉及的四种元素的原子序数之和等于28;V由一种金属元素和两种非金属元素组成,其原子个数比为1︰3︰9,所含原子总数等于其组成中金属元素的原子序数。它们之间的反应关系如下图:
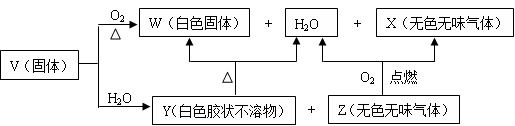
(1)写出W物质的一种用途 。
(2)写出V与足量NaOH溶液反应的化学方程式 。
(3)将过量的X通入某种物质的水溶液中可以生成Y,该反应的离子方程式为 。
(4)4 g Z完全燃烧生成X和液态水放出222.5 kJ的热量,请写出表示Z燃烧热的热化学方程式 。
(5)在200 mL 1.5 mol·L-1 NaOH溶液中通入标准状况下4.48 L X气体,完全反应后所得溶液中,各种离子浓度由大到小的顺序是 。
(6)Y是一种难溶物质,其溶度积常数为1.25×10-33。将0.01 mol Y投入1 L某浓度的盐酸中,为使Y完全溶解得到澄清透明溶液,则盐酸的浓度至少应为 (体积变化忽略不计,结果保留三位有效数字)。
根据下表所示化学反应与数据关系:
| 化学反应 |
平衡常数 |
温度 |
|
| 973K |
1173K |
||
① |
 |
1.47 |
2.15 |
②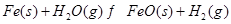 |
 |
2.38 |
1.67 |
③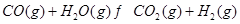 |
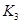 |
? |
? |
请回答:
(1)反应①是 (填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(3)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有 (填写字母序号)。
A 缩小反应容器的容积 B 扩大反应容器的容积 C 升高温度
D 使用合适的催化剂 E 设法减小平衡体系中的CO的浓度
(4)若反应③的逆反应速率与时间的关系如图所示:

①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时 ,t8时 。
②若t4时降压,t6时增大反应物的浓度,请在图中画出 ~
~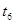 时逆反应速率与时间的关系线。
时逆反应速率与时间的关系线。
已知由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示,B、X为单质,D常温下为无色液体,A、B含同一种元素。(某些产物可能略去)
请回答下列问题:
(1)若E是有色气体,F是一元强酸,反应①是工业制备F的第一步反应。
①写出A与X反应的化学方程式: 。
②A的分子结构模型为 。
③已知常温下46g气体E发生反应③放出46kJ热量,写出气体E与H2O反应的热化学方程式 。
④在常温下,向V1LpH=a的A溶液中加入V2LpH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则V1和V2的关系为V1 V2(填 无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是 。(写出一种情况即可)
无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是 。(写出一种情况即可)
(2)若E为无色无味气体,F是二元弱酸。
①E的电子式为 ;
②将少量气体E通入氢氧化钡溶液中得不溶物H,H的Ksp=8.1×10—9。现将该沉淀放入0.1mol/L的BaCl2溶液中,其Ksp ,(填:增大、减小或不变),此时,组成不溶物H的阴离子在溶液中的浓度为 mol/L。
X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料.用化学用语回答下列问题:
(1)M的离子结构示意图 ;L在元素周期表中的位置为 .
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是 .
(3)Y的最高价氧化物的电子式为 .原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 .
(4)Z、W各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为 .
(5)R与Y同周期,R的单质分子R2中有3个共价键,R与X形成化合物甲,1mol甲含18mol电子,请写出甲的结构式 .
(6)用亚硝酸氧化化合物甲,可生成氮的另一种氢化物,该氢化物的相对分子质量为43,其中氮原子的质量分数为97.7%,该氢化物的分子式为 .该氢化物受撞击时完全分解为氮气和氢气,则2.15g该氢化物受撞击后产生的气体在标况下的体积为 L.
某温度时,在1L密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图所示。由图中数据分析:
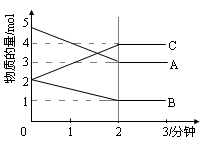
(1)该反应的化学方程式: ;
(2)反应开始至2min末,A的反应速率为 ;
(3)该反应是由 开始进行的。填序号
①正反应 ②逆反应 ③正逆反应同时
(1)如果反应物所具有的总能量大于生成物所具有的总能量,反应物转化为生成物时 (填吸收或放出)热量,△ H (填大于或小于)0;
(2)对于反应2SO2 + O2 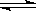 2SO3 其它条件不变,只改变一个反应条件,将生成SO3的反应速率的变化填入表中空格里 。(填字母 A.增大 B.减小 C.不变)
2SO3 其它条件不变,只改变一个反应条件,将生成SO3的反应速率的变化填入表中空格里 。(填字母 A.增大 B.减小 C.不变)
| 改变条件 |
速率变化 |
||
| 降低温度 |
|
||
| 增大O2的浓度 |
|
||
| 使用V2O5做催化剂 |
|
||
| 压缩气体 |
|
印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”生成CuCl2和FeCl2,其反应的化学方程式如下: Cu + 2FeCl3 ═ CuCl2 + 2FeCl2
(1)该反应的氧化剂是 。
(2)写出FeCl3的电离方程:
(3)使用过的腐蚀液会失效,但还可以回收利用,其中有一步需要将Fe2+转化为Fe3+,下列试剂能实现上述变化的是 (填序号)
| A.氯气 | B.铁 | C.铜 | D.稀硫酸 |