安徽省皖江名校高三上学期12月联考化学试卷
下列有关说法正确的是
| A.月饼等食品常在包装中放人生石灰做脱氧剂 |
| B.埃博拉病毒能够通过气溶胶传播,病毒颗粒直径大约为80nm |
| C.纤维素可水解成葡萄糖,故可为人体提供营养 |
| D.用Na2FeO4处理污水,可杀菌消毒,但不能沉降水中的悬浮物 |
下列有关化学用语表示正确的是
A. 为羟基的电子式,也是氢氧根离子的电子式 为羟基的电子式,也是氢氧根离子的电子式 |
B.S2-的结构示意图: |
C.甲烷分子的比例模型是 |
| D.中子数为10的氧原子:18O |
下列有关物质分类或归纳的说法中,正确的是
| A.SO2、NO2和CO2都是污染性气体 |
| B.熟石灰、铝热剂、盐酸都是混合物 |
| C.煤的干馏、海水中提取碘的过程都包括化学变化 |
| D.A12O3、Cl2、CuSO4在熔融状态或溶于水时均能导电,都属电解质 |
运用有关概念判断下列说法正确的是
| A.NH4Cl中有离子键,是离子化合物 |
| B.46g C2H5OH燃烧放出的热量为乙醇的燃烧热 |
C.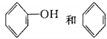 互为同系物 互为同系物 |
| D.绿色化学的核心是应用化学原理对环境污染进行治理 |
我国学者成功发现了新的一类水分解产氢催化剂:通过调控三氧化钨(WO3)局部原子结构,制备出的深蓝色钨氧化物(WO2.9)。该种钨的氧化物能高效而快速地催化水分解产生H2。下列有关说法正确的是
| A.WO3和WO2.9是同分异构体 |
| B.由WO3制备WO2.9的过程发生了氧化还原反应 |
| C.18g H2O在WO2.9的高效催化下产生H2体积为22. 4L |
| D.利用这种新型催化剂分解水的同时可放出热量 |
金属铈(58Ce)常用于制作稀土磁性材料,可应用于制造玻璃、打火石、陶瓷和合金等。已知:Ce4++Fe2+=Ce3+ +Fe3+。下列说法正确的是
| A.可用电解熔融CeO2制取金属铈,铈在阳极生成 |
B.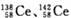 是同素异形体 是同素异形体 |
| C.铈能溶于HI溶液,发生反应的离子方程式为:Ce+4H+=Ce4++2H2 |
| D.铈的原子核外有58个电子 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.使甲基橙变红的溶液中:Na+、Cl-、CH3 COO-、Fe2+ |
| B.水电离的OH-浓度为10-12mol.L-1的溶液中:Mg2+、NH4+、AlO2-、SO32- |
| C.无色溶液中:Al3+、NO3-、Cl-、SO42- |
| D. c(K2C2O4) ="0." 5mol/L溶液中:Na+、K+、MnO4-、Cl- |
设NA表示阿伏加德罗常数的值,下列说法正确的是
| A.25℃时,1L pH=ll的CH3COONa溶液中水电离出的OH-的数目为0.001NA |
| B.28g乙烯和丙烯的混合气体含有的原子个数为3NA |
| C.1mol·L-l NaHCO3溶液中含有HCO3数目小于NA |
| D.1mol Cl2与足量NaOH溶液反应时转移电子数为2NA |
2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖。青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是
| A.分子式为C15H22O4 | B.具有较强的还原性 |
| C.可用蒸馏水提取植物中的青蒿素 | D.碱性条件下能发生水解反应 |
下列化学反应的离子方程式正确的是
| A.Cu溶于稀硝酸:Cu+2H++NO3-=Cu2++NO2+H2O |
| B.NaAlO2溶液中通入过量CO2气体:AlO2-+CO2+2H2O= Al(OH)3+HCO3- |
| C.用CH3COOH溶解CaCO3:CaCO3+2H+= Ca2++H2O+CO2 |
| D.NH4 HCO3溶液与足量的NaOH溶液反应:HCO3-+OH- =CO32-+H2O |
下列实验能获得成功的是
| |
实验目的 |
实验步骤 |
| A |
比较CH3COOH和H2CO3酸性强弱 |
测同浓度的Na2CO3、CHCOONa溶液的pH |
| B |
比较S和Si非金属性强弱 |
向Na2SiO3溶液中通入SO2出现浑浊 |
| C |
除去KNO3中少量NaCl |
将混合物制成热的饱和溶液,冷却结晶,过滤 |
| D |
探究蔗糖水解的产物中是否含有葡萄糖 |
取少量蔗糖溶液加稀硫酸,水浴加热几分钟后,再加入新制的氢氧化铜悬浊液并且加热 |
A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大。A原子是所有原子中半径最小的,B原子的最外层电子数是次外层的3倍,C是第三周期最活泼的金属,D与B是同主族元素。下列说法正确的是
A.原子半径r(E)>r(D)>r(B)
B.A分别与C、E形成的化合物中化学键类型相同
C.熔沸点:A2B<A2D
D.化合物DB2的排放是形成酸雨的原因
科学家尝试用微生物电池除去废水中的有害的有机物,其原理如图所示。下列有关说法错误的是
A.A极电极反应式为: |
| B.B极电极反应式为:CH3COO--8e-+4H2O=2HCO3-+9H+ |
| C.溶液中的阴离子由A极向B极移动 |
| D.该微生物电池在高温条件下无法正常工作 |
关于下列各装置的叙述中,正确的是
| A.装置①可用于分离I2与NH4Cl混合物 |
| B.装置②收集并测量Cu与浓硫酸反应产生的气体的体积 |
| C.装置③制取氯气 |
| D.装置④制取无水MgCl2 |
某款香水中的香氛主要由以下三种化合物构成,下列说法正确的是
| A.月桂烯分子中所有原子可能共平面 |
| B.柠檬醛和香叶醇是同分异构体 |
| C.香叶醇能发生加成反应、氧化反应、酯化反应 |
| D.三种有机物的一氯代物均有7种(不考虑立体异构) |
下列有关物质的性质类比正确的是
A.已知Fe+S FeS,则Cu+S FeS,则Cu+S CuS CuS |
| B.Fe能与CuSO4溶液反应,可知Al与CuSO4溶液也能反应 |
| C.CaS03与稀盐酸反应生成SO2,可知CaSO3与稀硝酸反应也生成SO2 |
| D.已知H2O2能氧化I一,可知H2O2也能氧化Cl- |
已知反应:CO(g) +3H2 (g)  .CH4 (g)+H2O(g)。起始以物质的量之比为1:1充人反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为)。下列有关说法正确的是
.CH4 (g)+H2O(g)。起始以物质的量之比为1:1充人反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为)。下列有关说法正确的是
| A.上述反应的△H<0 |
| B.N点时的反应速率一定比M点快 |
| C.降低温度,H2的转化率可达到100% |
| D.工业用此法制取甲烷应采用更高的压强 |
已知以下反应可用于去除大气中的污染:NO2+NH3 +O2—一N2+H2O(未配平)。若NO2、NH3、
O2三者恰好反应,则体积比可能是
| A.2:4:1 | B.2:1:2 | C.l:1:1 | D.l:4:3 |
铁及其化合物有丰富多彩的化学性质。回答下列问题:
(1)铁元素在周期表中的位置为第___________周期第__________族。
(2) FeCl3溶液可用于吸收尾气中的SO2,写出该反应的离子方程式:_____________。
(3)某化学兴趣小组同学用下图装置,充分加热硫酸亚铁晶体(FeSO4.xH2O)至完全分解。
①装置A中需持续通入N2,其目的是
②充分反应一段时间后,小组同学观察到实验现象为:装置A中残留有红棕色固体,装置B中固体变蓝,C中溶液褪色,请写出FeSO4分解的化学方程式:________。
③装置D中干燥管的作用为__________。
④小组同学利用数字化实验仪器测定了不同温度时FeSO4.xH2O分解的质量变化情况,得到下
图关系:
实验结束后后,装置B质量增加12. 6g,结合上图数据,确定FeSO4·xH2O中的x=
工业上可用以下方案使饮用水中NO3-含量达标。

请回答下列问题:
(1)调节pH不宜过大或过小,否则会造成Al的利用率降低;试剂X可选用________(填序号)。
A NaOH B Ca(OH)2 C NH3.H2O D CuO E CO2
(2)流程中操作①的名称为__________,若在实验室中进行此操作,所需要的玻璃仪器是___________。
(3)写出溶液中铝粉和NO3-反应的离子方程式:______________________。
(4)还可用以下化学反应使饮用水中NO3-含量达标,产物之一是空气的主要成分。完成下列离子方程式:

CCUS是一种二氧化碳的捕获、利用与封存的技术,这种技术可将CO2资源化,产生经济效益.
(1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=-820kJ/mol
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=-41.2kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H3=-566kJ/mol
则反应的CO2(g)+CH4(g) 2CO(g)+2H2(g)的△H=___________。
2CO(g)+2H2(g)的△H=___________。
(2)工业上,可利用太阳能以CO2为原料制取C,其原理如下图所示:

整个过程中__________(填“Fe3O4”或“FeO”)是反应的催化剂。重整系统中发生的反应为6FeO+CO2 2Fe2O3+C,每生成1molFe3O4,转移电子的物质的量为____________。
2Fe2O3+C,每生成1molFe3O4,转移电子的物质的量为____________。
(3)CO2还可用于合成甲醇,其热化学方程式为:CO2(g)+H2(g) CH3OH(g)+H2O(g) △H<0
CH3OH(g)+H2O(g) △H<0
①该反应的平衡常数表达式为____。
②在恒容的密闭容器中,加入H2和CO2的混合气体,不同温度条件,反应相同时间后,测得甲醇的体积分数甲(CH3OH)如图所示。图中A、B、C、D、E五个点对应的状态中,处于平衡状态的是_______ (填字母),B点和E点的反应速率大小关系为v(B) v(E)(填“>”、“<”、“=”)。

③一定温度下,在甲、乙两个容积相同的密闭容器中,加入H2和CO2的混合气体。
| 容器 |
甲 |
乙 |
| 反应物投入量 |
1molCO2、3molH2 |
amolCO2、bmolH2、cmolCH3OH(g)、cmolH2O(g) |
甲容器平衡后气体的压强为开始时的80%,要使乙容器达平衡时与甲容器达到相同的平衡状态,且起始时反应逆向进行,则c的取值范围为___________。
锰的化合物种类较多,也大多具有广泛的用途。
I.MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性。某化学兴趣小组通过实验探究MnO2的性质。
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是_____________。
A.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
B.把MnO2固体加入到H2O2溶液中,观察是否有气泡产生
C.Na2 SO3溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成
D.FeSO4溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红
(2)为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在
室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL 0.2mol/L NaOH溶液、1mL水、1mL 0.1mol/L硫酸。现象记录如下:
| 试管编号 |
实验现象 |
| A |
溶液不变色 |
| B |
溶液缓慢变浅棕褐色 |
| C |
溶液迅速变棕褐色 |
从以上实验中,我们可以得出的结论是____________。
②写出C试管中发生反应的离子方程式:________________。
Ⅱ,铁酸锰( MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机。MnFe2O4的制备工艺流程如下图:
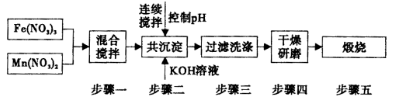
已知Fe3+、Mn2+沉淀的pH如表所示。
| |
开始沉淀 |
完全沉淀 |
| Fe3+ |
2.7 |
4.2 |
| Mn2+ |
8.3 |
10.4 |
①步骤一中投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比理论上应为___________________。
②步骤二中需控制pH的范围是_______________
③步骤三中是否洗涤干净的判断方法是_____________.
 粤公网安备 44130202000953号
粤公网安备 44130202000953号